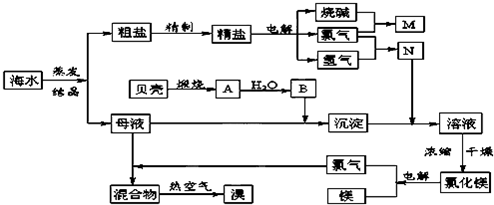
【答案】
分析:(1)根据根据SO
42-、Ca
2+、Mg
2+等易转化为沉淀而被除去,以及根据不能产生新杂质的要求排序,前面加入的过量溶液应用后加入的溶液除去,最后加入适量的溶液;
(2)电解池中和电源的正极相连的是电解池的阳极,发生失电子的氧化反应;阳离子交换膜只允许阳离子通过,而阴离子不能通过;
(3)依据电极原理和生成产物写出电解饱和NaCl溶液的离子反应方程式:
(4)工业制备用到石灰石的有炼铁除硫磷,玻璃制备,水泥制备等;
(5)氯化镁失水发生水解生成氢氧化镁沉淀,为防止水解应在氯化氢气流中加热脱水;
(6)溴单质具有氧化性,亚硫酸钠具有还原性发生氧化还原反应生成硫酸钠和氢溴酸.
解答:解:(1)SO
42-、Ca
2+、Mg
2+等分别与BaCl
2溶液、Na
2CO
3溶液、NaOH溶液反应生成沉淀,可再通过过滤除去,Na
2CO
3溶液能除去过量的BaCl
2溶液,盐酸能除去过量的Na
2CO
3溶液和NaOH溶液,所以应先加BaCl
2溶液再加Na
2CO
3溶液,最后加入盐酸,所以正确顺序为BDCA 或 CBDA 或BCDA等
故答案为:BDCA 或 CBDA 或BCDA等;
(2)A、阳极是氯离子失电子发生氧化反应,精制饱和食盐水进入阳极室,故A正确;
B、阴极是氢离子得到电子生成氢气,纯水(加少量NaOH)进入阴极室,故B正确;
C、阴极是氢离子得到电子生成氢气发生还原反应,阴极附近水电离平衡破坏,氢氧根离子浓度增大结合钠离子生成氢氧化钠,故C正确;
D、.电解槽的阳极是石墨电极,溶液中的氯离子失电子生成氯气,若用用金属铁网制成,则铁是电子发生氧化反应,生成的亚铁离子和氢氧根离子形成沉淀,得不到氯气和烧碱,故D错误;
故选D.
(3)电解过程中阳极上氯离子失电子发生氧化反应,2Cl
--2e-=Cl
2↑;阴极上是氢离子得到电子生成氢气,电极反应为:2H
++2e
-=H
2↑;电解池中反应的离子方程式为:2Cl
-+2H
2O

Cl
2↑+H
2↑+2OH
-,故答案为:2Cl
-+2H
2O

Cl
2↑+H
2↑+2OH
-;
(4)石灰石可以用作制玻璃的原料,发生的反应为:CaCO
3+SiO
2
CaSiO
3+CO
2↑,故答案为:2Cl
-+2H
2O

Cl
2↑+H
2↑+2OH
-;
(5)氯化镁在水中乙发生水解,为抑制水解,氯化镁晶体应在氯化氢气流中脱水,故答案为:在HCl气流中加热脱水(防止MgCl
2水解);
(6)溴单质具有氧化性,亚硫酸钠具有还原性发生氧化还原反应生成硫酸钠和氢溴酸;反应的化学方程式为:H
2O+Na
2SO
3+Br
2═Na
2SO
4+2HBr,故答案为:H
2O+Na
2SO
3+Br
2═Na
2SO
4+2HBr.
点评:本题考查了电解池的工作原理知识,粗盐提纯的实验方案设计步骤及注意事项以及化学方程式的书写,化学来源于生产、生活,又服务于生产、生活,学习中注意积累化学知识,才能综合应用,题目难度中等.

 Cl2↑+H2↑+2OH-,故答案为:2Cl-+2H2O
Cl2↑+H2↑+2OH-,故答案为:2Cl-+2H2O Cl2↑+H2↑+2OH-;
Cl2↑+H2↑+2OH-; CaSiO3+CO2↑,故答案为:2Cl-+2H2O
CaSiO3+CO2↑,故答案为:2Cl-+2H2O Cl2↑+H2↑+2OH-;
Cl2↑+H2↑+2OH-;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
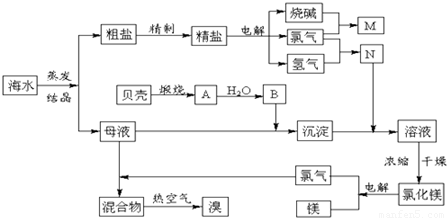
小学生10分钟应用题系列答案 海水中含有丰富的化学元素,如图是某化工厂利用海水的生产镁的流程简图,请回答:
海水中含有丰富的化学元素,如图是某化工厂利用海水的生产镁的流程简图,请回答: