
 某学校实验小组同学欲探究温度对化学平衡的影响,做如下实验:
某学校实验小组同学欲探究温度对化学平衡的影响,做如下实验:分析 (1)二氧化氮与四氧化二氮的之间存在转化关系,该反应为可逆反应;二氧化氮为红棕色气体,所以混合气体为红棕色;
(2)根据题中实验操作方法及装置特点判断该实验目的;
(3)氢氧化钠的溶解及中和反应为放热反应,硝酸铵的溶解为吸热反应,据此判断甲乙烧杯中溶液温度变化;
(4)根据实验操作方法及实验现象得出实验结论.
解答 解:(1)二氧化氮与四氧化二氮之间的转化关系为:2NO2?N2O4,四氧化二氮为无色,而二氧化氮为红棕色,则烧瓶中气体颜色为红棕色,
故答案为:2NO2?N2O4;红棕色;
(2)根据实验步骤及实验装置可知,该实验目的是探究温度对化学平衡的影响,
故答案为:温度对化学平衡的影响;
(3)由于甲烧杯中NaOH溶解过程放热,且氢氧化钠中和HCl也是放热反应,导致溶液的温度升高,而乙中NH4NO3溶解过程吸热,导致溶液的温度降低,
故答案为:升高;降低;甲中NaOH溶解放热,中和HCl也放热,使溶液的温度升高;乙中NH4NO3溶解吸热,使溶液的温度降低;
(4)分别向甲、乙烧杯中加入NaOH固体和NH4NO3固体后,甲烧杯中温度升高,A中气体颜色变深,乙烧杯温度降低,B瓶中气体颜色变浅,说明温度影响化学平衡,
故答案为:温度使化学平衡移动.
点评 本题考查了探究温度对化学平衡的影响,题目难度中等,明确氢氧化钠的溶解、中和反应为放热反应、硝酸铵的溶解为吸热反应为解答关键,注意掌握温度、浓度等因素对化学平衡的影响.


科目:高中化学 来源: 题型:选择题
 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间(t)产生气体体积(V)的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能是( )
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间(t)产生气体体积(V)的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能是( )| 组别 | C(HCL)(mol/L) | 温度(℃) | 状态 |
| 1 | 2.0 | 25 | 块状 |
| 2 | 2.5 | 30 | 块状 |
| 3 | 2.5 | 50 | 块状 |
| 4 | 2.5 | 30 | 粉末状 |
| A. | 3-4-1-2 | B. | 1-2-4-3 | C. | 4-2-3-1 | D. | 4-3-2-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸和乙醇的混合液(3:1)加热至140℃ | |
| B. | 浓硫酸和苯的混和液加热至80℃ | |
| C. | 煮沸氯乙烷和苛性钾溶液 | |
| D. | 煮沸氯乙烷和苛性钾的醇溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3+2H2O?H2CO3+2NaOH | B. | NH3•H20?NH4++OH- | ||
| C. | CH3COOH?H++CH3COO- | D. | Na2SO3+H2O?NaHS03+NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是实验室制备SO2并验证SO2某些性质的装置图.
如图是实验室制备SO2并验证SO2某些性质的装置图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用图1装置构成锌--铜原电池 | |
| B. | 用图2装置选择裂化汽油提取溴水中溴 | |
| C. | 用图3装置灼烧碳酸钙制取少量氧化钙 | |
| D. | 用图4装置验证在该条件下铁钉发生吸氧腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
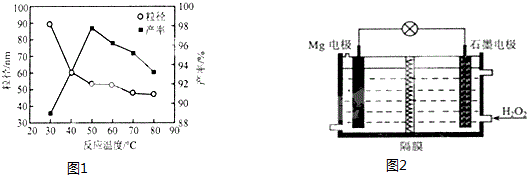
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com