
| A. | 金属在原电池中做正极被保护 | |
| B. | 原电池中阴离子向负极移动 | |
| C. | 常温下,强酸强碱在稀溶液中反应的中和热是-57.3KJ.mol-1 | |
| D. | 用惰性电极电解CuSO4溶液,外电路中每通过1mol电子,溶液中就产生1mol H+ |
分析 A.原电池正极发生还原反应;
B.原电池工作时,阴离子向负极移动,阳离子向正极移动;
C.常温下,强酸强碱在稀溶液中反应的中和热是57.3KJ.mol-1;
D.阳极发生2H2O-4e-=O2↑+4H+或4OH--4e-=2H2O+O2↑,结合电极方程式计算.
解答 解:A.原电池正极发生还原反应,可防止金属被氧化,故A正确;
B.原电池工作时,阴离子向负极移动,阳离子向正极移动,故B正确;
C.常温下,强酸强碱在稀溶液中反应的中和热是57.3KJ.mol-1或△H=-57.3KJ.mol-1,故C错误;
D.阳极发生2H2O-4e-=O2↑+4H+或4OH--4e-=2H2O+O2↑,由电极方程式可知外电路中每通过1mol电子,溶液中就产生1mol H+,故D正确.
故选C.
点评 本题综合考查原电池和电解池原理,为高频考点,侧重于学生的分析能力的考查,根据原电池正负极和电解池阴阳极上得失电子分析解答,难度不大.


科目:高中化学 来源: 题型:解答题
| 元素 | 结构或性质信息 |
| T | 原子的L层上s电子数等于p电子数. |
| X | 元素的原子半径是第三周期主族元素中最大的. |
| Y | 空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的. |
| Z | 单质常温、常压下是气体.原子的M层上有1个未成对的p电子. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
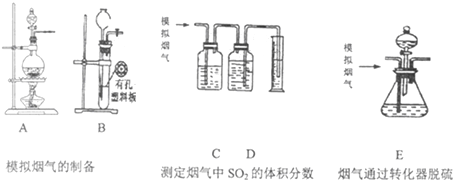
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 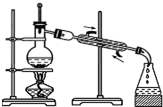 分离沸点相差较大液体混合物 | B. | 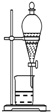 分离互不相溶的两种液体 | ||
| C. | 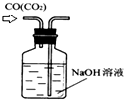 除去CO气体中的CO2气体 | D. | 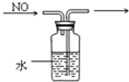 排水集气法收集NO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸浓度不变,使用量增大1倍 | B. | 盐酸浓度增加1倍,但用量减至1/2 | ||
| C. | 将碳酸钙固体改为碳酸钙粉末 | D. | 加热此反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com