
分析 (1)依据题干可知Na2C03和Na2S以1:2的物质的量之比混合,再通入二氧化硫发生反应生成Na2S2O3和二氧化碳,依据原子个数守恒、得失电子守恒书写方程式;
依据过氧化钠结构结合氧原子、硫原子结构解答;
(2)酸性环境下S2O32-发生歧化反应,消耗的硫代硫酸根钠偏多,测定结果会偏高;
(3)工业上用大苏打溶液吸收工业废气中的氯气,其氧化产物为SO42-,离子反应方程式为:S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+;
(4)将硫酸钙转化为易除的碳酸钙;
(5)Na2O2与足量的NaHCO3混合后,在密闭容器中充分加热,可能发生的反应有:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,CO2+2NaOH=Na2CO3+H2O,残留固体为纯净物,则为碳酸钠,由此分析解答.
解答 解:(1)依据题干可知Na2C03和Na2S以1:2的物质的量之比混合,再通入二氧化硫发生反应生成Na2S2O3和二氧化碳,反应中S元素的化合价从-2价升高到+2价,S的化合价从+4价降低到+2价,依据原子个数守恒、得失电子守恒反应的方程式:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2;
Na2S溶液在空气中长期放置,和氧气反应生成与过氧化钠的结构及化学性质相似的物质Na2S2;
故答案为:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2;Na2S2;
(2)酸性环境下S2O32-发生歧化反应,离子方程式:S2O32-+2H+=S↓+H2O+SO2↑,故答案为:S2O32-+2H+=S↓+H2O+SO2↑;
(3)工业上用大苏打溶液吸收工业废气中的氯气,其氧化产物为SO42-,离子反应方程式为:S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+;故答案为:S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+;
(4)将硫酸钙转化为易除的碳酸钙,离子反应方程式为:将CaSO4转化为CaCO3,CaSO4+CO32-=CaCO3+SO42-,故答案为:将CaSO4转化为CaCO3,CaSO4+CO32-=CaCO3+SO42-;
(5)Na2O2与足量的NaHCO3混合后,在密闭容器中充分加热,可能发生的反应有:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,CO2+2NaOH=Na2CO3+H2O,残留固体为纯净物,则为碳酸钠,则n(NaHCO3):n(Na2O2)≥2,故答案为:≥2.
点评 本题考查了氧化还原反应,侧重考查氧化还原反应方程式的书写,明确氧化还原反应得失电子守恒规律是解题关键,题目难度中等.


科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④① | B. | ④②③① | C. | ④③①② | D. | ②①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ④⑥ | C. | ①④⑥ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象或事实 | 解释 |
| A | 已知水热反应是指在高温高压下,将二氧化碳转化为有机物的技术 | 水热反应可以降低自然界中碳的含量 |
| B | 用铝制易拉罐收集满CO2,加入过量NaOH浓溶液,立即把口封闭.发现易拉罐“咔咔”作响并变瘪了,过了一会儿,易拉罐又会作响并鼓起来 | 导致易拉罐又鼓起来的反应是: Al3++3HCO3-=Al(OH)3+3CO2↑ |
| C | FeCl3溶液可用于制作铜质印刷线路板的“烂板液” | FeCl3溶液能将铜氧化为Cu2+ |
| D | 用浸泡过高锰酸钾溶液的硅藻土吸收水果产生的乙烯以达到保鲜目的 | 乙烯能够与高锰酸钾溶液发生加成反应,从而起到去除乙烯的目的 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
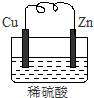 由铜片、锌片和200ml稀H2SO4组成的原电池中,一段时间后某极产生3.36L(标准状况)的气体.
由铜片、锌片和200ml稀H2SO4组成的原电池中,一段时间后某极产生3.36L(标准状况)的气体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com