
| A. | 将5 mL 0.02 mol/L的H2SO4溶液与5 mL 0.02 mol/L NaOH溶液充分混合,若混合后溶液的体积为10 mL,则混合液的pH=2 | |
| B. | 某物质的溶液中由水电离的c(H+)=1×10-a mol/L,若a>7,则pH一定为14-a | |
| C. | pH相等的①CH3COONa ②C6H5ONa ③NaHCO3溶液,c(Na+)大小关系:①>③>② | |
| D. | CH3COONa溶液中加入少量KNO3固体后的碱性溶液一定有:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
分析 A.混合溶液中c(H+)=$\frac{0.02mol/L×0.005l×(2-1)}{0.01L}$=10-2 mol/L,根据pH计算公式计算溶液pH值;
B.酸或碱都抑制水电离,含有弱根离子的盐促进水电离;
C.酸的酸性越小,酸电离程度越小,则酸根离子水解程度越大,pH相等的不同钠盐,酸根离子水解程度越大的其溶液浓度越小;
D.任何电解质溶液中都存在电荷守恒.
解答 解:A.混合溶液中c(H+)=$\frac{0.02mol/L×0.005l×(2-1)}{0.01L}$=10-2 mol/L,溶液pH值为2,故A正确;
B.某物质的溶液中由水电离的c(H+)=1×10-amol/L,若a>7,说明该物质抑制水电离,该物质可能是酸或碱,如果是酸,则pH=14-a,如果是碱,则pH=a,故B错误;
C.酸的电离程度大小顺序是①CH3COOH>②C6H5OH>③HCO3-,酸的电离程度越大,其酸根离子水解程度越小,pH相等的钠盐溶液中其浓度越大,所以pH相等的①CH3COONa、②C6H5ONa、③NaHCO3溶液中,钠盐浓度大小顺序是:①>③>②,故C正确;
D.硝酸钾是强酸强碱盐,根据物料守恒知,c(K+)=c(NO3-),溶液中存在电荷守恒c(Na+)+c(H+)+c(K+)=c(NO3-)+c(CH3COO-)+c(OH-),所以得c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故D正确;
故选B.
点评 本题考查了酸碱混合溶液定性判断及离子浓度大小的比较,明确物质的性质是解本题关键,结合电荷守恒和物料守恒来分析解答,易错选项是BC,注意苯酚酸性大于碳酸氢根离子,很多同学把B选项只考虑一种情况而导致错误,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
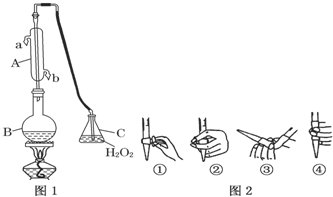
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
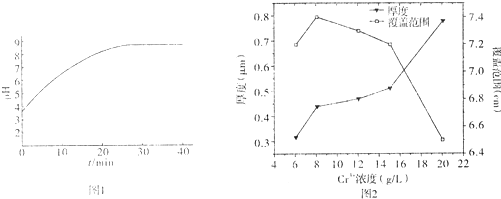
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
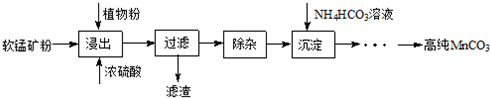
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Y>X,离子半径Z<W | |
| B. | 元素Y的单质能与元素X的最高价氧化物发生置换反应 | |
| C. | 元素Y和W能形成YW2型离子化合物 | |
| D. | W的单质有毒,能使湿润的有色布条褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
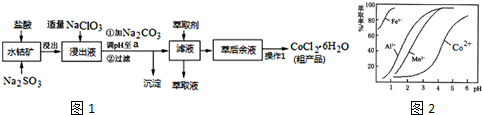
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验设计 | 观察或记录 | 结论或解释 |
| A | 将浓硝酸分多次加入Cu和稀硫酸的混合液中 | 产生红棕色气体 | 浓硝酸的还原产物是NO2 |
| B | 测某铵盐溶液的pH | pH>7 | NH4+水解生成NH3•H2O,使溶液显碱性 |
| C | 用湿润的淀粉碘化钾试纸检验某气体 | 试纸变蓝 | 该气体一定是Cl2 |
| D | 将盛少量水的分液漏斗静置、倒置、将塞子旋转1800后再次倒置 | 漏斗口和活塞不漏水 | 分液漏斗不漏液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com