
 Ӧ��Br2 +2Fe2+=2 Br -+2Fe3+,��10 mL0 .1mol/L��Fe Br2��Һ��ͨ��0 .003mol Cl2���÷�Ӧ�����ӷ���ʽΪ
Ӧ��Br2 +2Fe2+=2 Br -+2Fe3+,��10 mL0 .1mol/L��Fe Br2��Һ��ͨ��0 .003mol Cl2���÷�Ӧ�����ӷ���ʽΪ  ��������Cu2O����Ϊ̫����ֽ�ˮ�Ĵ�����
��������Cu2O����Ϊ̫����ֽ�ˮ�Ĵ����� ����2L�ܱ������м���������Cu2O��ͨ��0 .1molˮ������������Ӧ��
����2L�ܱ������м���������Cu2O��ͨ��0 .1molˮ������������Ӧ��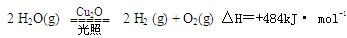 2 H2O(g)
2 H2O(g) | ʱ��/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
 ��ѧ����ͬ����ϰϵ�д�
��ѧ����ͬ����ϰϵ�д� ��ǰ�κ�ͬ����ϰϵ�д�
��ǰ�κ�ͬ����ϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
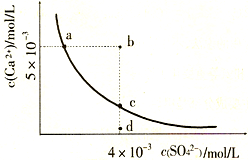
| A�������£���100mL CaSO4������Һ�У�����400mL 0.01mol/LNa2SO4��Һ����Һ���г������� |
| B��b�㽫�г������ɣ�ƽ�����Һ��c(SO42-)һ������3��10-3 mol/L |
| C��d����Һͨ���������Ա䵽c�� |
| D��a���Ӧ��Ksp����c���Ӧ��Ksp |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
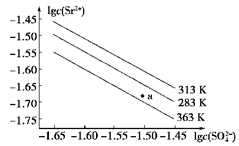
| A���¶�һ��ʱ��Ksp(SrSO4)��c(SO42��)���������С |
| B��������ͬ�¶��У�313 KʱKsp(SrSO4)��� |
| C��283 Kʱ��ͼ��a���Ӧ����Һ�DZ�����Һ |
| D��283 K�µ�SrSO4������Һ���µ�363 K���Ϊ��������Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��25��Cʱ������Mg(OH)2��Һ�뱥��MgF2��Һ��ȣ�ǰ�ߵ�c(Mg2+)�� |
| B��25��Cʱ����Mg(OH)2������Һ����������NH4Cl���壬c(Mg2+)���� |
| C��25��Cʱ��Mg(OH)2������20mL0.01 mol��L-1��ˮ�е�Ksp����20mL0.01mol��L-1NH4Cl��Һ�е�KspС |
| D��25��Cʱ����Mg(OH)2������Һ�м���NaF��Һ��Mg(OH)2������ת��ΪMgF2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�� 6; 6��10-7 mol��L��1 | B�� 7; 1��10-5 mol��L��1 |
| C��7 ; 4��10-8 mol��L��1 | D�� 6; 1�� 10-5 mol��L��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��AgCl=AgI=Ag2S | B��AgCl��AgI��Ag2S |
| C��AgCl��AgI��Ag2S | D��AgI��AgCl��Ag2S |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 Cu2����aq����2OH����aq������������Ksp��2��10��20��
Cu2����aq����2OH����aq������������Ksp��2��10��20��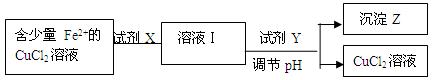
| ���� ���� | pH | |
| ��ʼ���� | ��ȫ���� | |
| Fe2+ | 7.6 | 9.6 |
| Cu2+ | 4.4 | 6.4 |
| Fe3+ | 2.7 | 3.7 |
 A.H2O2 B.KMnO4 C.HNO3 D.Cl2
A.H2O2 B.KMnO4 C.HNO3 D.Cl2�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com