
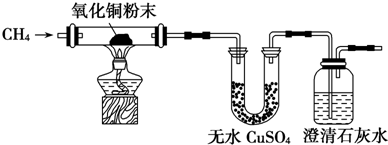
分析 (1)无水CuSO4逐渐变蓝,说明有水生成,澄清石灰水出现浑浊,说明有二氧化碳生成,据此分析反应物和生成物书写方程式;
(2)CH4通入溴水时,发现溴水逐渐褪色,说明溴参加了反应或溴被带走,因甲烷为饱和烃,所以溴单质可能与甲烷发生了取代反应或溴单质被甲烷气体带走,假如发生取代反应有溴化氢生成,用pH试纸检验反应前后溶液的pH验证,若溴单质被甲烷气体带走,也可用pH试纸检验反应前后溶液的pH.
解答 解:(1)五水合硫酸铜为蓝色,无水CuSO4逐渐变蓝,说明有水生成,澄清石灰水出现浑浊,说明有二氧化碳生成,根据原子守恒,CH4与CuO反应的化学方程式为:CH4+4CuO$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4Cu+2H2O,
故答案为:CH4+4CuO$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4Cu+2H2O;
(2)CH4通入溴水时,发现溴水逐渐褪色,说明溴参加了反应或溴被带走,因甲烷为饱和烃,所以溴单质可能与甲烷发生了取代反应或溴单质被甲烷气体带走,假如发生取代反应,必有溴化氢产物,用pH试纸检验反应前后溶液的pH,如果pH明显变小,则表明二者可能发生了取代反应,若溴单质被甲烷气体带走,溴单质溶于水显酸性,用pH试纸检验反应前后溶液的pH,如果pH没有明显变化,则表明溴单质可能被甲烷气体带走,
故答案为:溴单质与甲烷发生了取代反应;用pH试纸检验反应前后溶液的pH,如果pH明显变小,则表明二者可能发生了取代反应(或溴单质被甲烷气体带走,用pH试纸检验反应前后溶液的pH,如果pH没有明显变化,则表明溴单质可能被甲烷气体带走).
点评 本题考查甲烷的性质实验设计与 评价,题目难度不大,注意相关基础知识的积累,CH4通入溴水时,发现溴水逐渐褪色有两种可能为该题解答的难点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO3 是酸性氧化物,能与NaOH溶液反应 | |
| B. | Na2O、Na2O2组成元素相同,与CO2反应产物也相同 | |
| C. | 金属氧化物一定是碱性氧化物 | |
| D. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤⑦ | B. | ②③④⑥ | C. | ②④⑤⑥⑦ | D. | ①②⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 灼烧RbH时,火焰有特殊颜色 | |
| B. | RbH中H+半径比Li+半径小 | |
| C. | 跟液氨反应时,有RbNH2生成 | |
| D. | 在Na、K、Rb三种单质中,Rb的熔点最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 说明乙醇分子中含有氢原子 | |
| B. | 说明乙醇分子中含有氧原子 | |
| C. | 说明乙醇分子中含有氢离子 | |
| D. | 说明乙醇分子中含有不同于烃分子里的氢原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com