
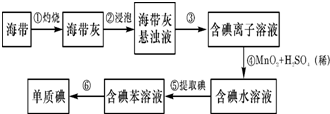
 ,
, ;
;

科目:高中化学 来源: 题型:
| A、1mol?L-1甲酸溶液的pH值约为2 |
| B、甲酸电离出的阳离子全部是H+ |
| C、10mL 1mol?L-1甲酸与10mL 1mol?L-1 NaOH溶液完全反应后,溶液呈碱性 |
| D、1L H+浓度为0.1mol?L-1的甲酸和足量Zn反应放出的H2在标况下远大于1.12L |
查看答案和解析>>
科目:高中化学 来源: 题型:
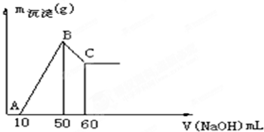 把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入1mol?L-1 NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积如图所示.
把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入1mol?L-1 NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
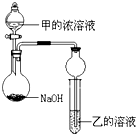 五种短周期元素的部分性质数据如下:
五种短周期元素的部分性质数据如下:| 元素 | T | X | Y | Z | W |
| 原子半径(nm) | 0.037 | 0.075 | 0.099 | 0.102 | 0.143 |
| 最高或最低化合价 | +1 | +5 -3 |
+7 -1 |
+6 -2 |
+3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
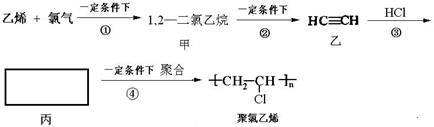
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | K+、Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、Cl-、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X、Y、Z既能形成离子化合物,又能形成共价化合物 |
| B、四种元素的原子半径由小到大的顺序为:r(X)<r(Y)<r(Z)<r(W) |
| C、X与其余三种元素之间形成的核外电子总数为10的微粒只有4种 |
| D、H2Z的沸点比H2W高,是因为它们的晶体类型不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com