
| A、1.7 | B、12.3 |
| C、12 | D、2 |
| V×0.06×2-V×0.1 |
| 2V |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、同族元素在性质上的相似性,取决于原子价电子排布的相似性 |
| B、电离能越小,表示气态时该原子越易失去电子 |
| C、元素的电负性越大,表示其原子在化合物中吸引电子能力越强 |
| D、电负性大的元素易呈现正价,电负性小的元素易呈现负价 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小 |
| B、配制溶液时,若在定容时仰视读数,会导致所配标准溶液的浓度偏大 |
| C、中和等体积、等物质的量的浓度的盐酸和醋酸所消耗的n(NaOH)相等 |
| D、25℃与60℃时,水的pH相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 聚合而成的,其化学方程式是
聚合而成的,其化学方程式是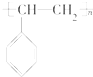 ),它是由
),它是由查看答案和解析>>
科目:高中化学 来源: 题型:
 今有反应X(g)+Y(g)?3Z(g);△H<0若反应开始经t1秒后达到平衡,经t2秒后,由于反应条件的改变使平衡破坏,t3时又达到平衡,如图示,试分析,从t2到t3秒曲线变化的原因是( )
今有反应X(g)+Y(g)?3Z(g);△H<0若反应开始经t1秒后达到平衡,经t2秒后,由于反应条件的改变使平衡破坏,t3时又达到平衡,如图示,试分析,从t2到t3秒曲线变化的原因是( )| A、增加了反应体系的压强 |
| B、使用了催化剂 |
| C、升高了反应的温度 |
| D、增大了X和Y的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、27min |
| B、9min |
| C、13.5min |
| D、3min |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水玻璃显碱性,滴入酚酞呈现红色 |
| B、工艺师利用盐酸刻蚀玻璃制作艺术品 |
| C、水晶项链和餐桌上的瓷盘都是硅酸盐制品 |
| D、单质硅是制造光导纤维的主要材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钙离子的电子式:Ca2+ |
| B、CO2分子的结构式:O=C=O |
C、Na的原子结构示意图: |
| D、氮气的电子式::N:::N: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com