
����Ŀ��ijѧ��������֪���ʵ���Ũ�ȵ��������ⶨδ֪���ʵ���Ũ�ȵ�����������Һʱ��ѡ���̪��ָʾ��������д���пհף�
��1���ñ���������Һ�ζ����������������Һʱ�����ְ�����ʽ�ζ��ܵĻ���������ҡ����ƿ���۾�ע�� �� ֱ��Ϊֹ��
��2�����в����п���ʹ��������������Һ��Ũ����ֵƫ�͵��� ��
A.��ʽ�ζ���δ�ñ�������Һ��ϴ��ֱ��ע���������Һ
B.�ζ�ǰʢ������������Һ����ƿ������ˮϴ����û�и���
C.��ʽ�ζ����ڵζ�ǰ�����ݣ��ζ���������ʧ
D.��ȡ�������ʱ����ʼ���Ӷ������ζ�����ʱ���Ӷ���
��3�����ζ���ʼ�ͽ���ʱ����ʽ�ζ����е�Һ����ͼ1��ͼ2��ʾ���뽫�����������Ŀհ״���
�ζ����� | ��������������Һ�����/mL | 0.1000mol/L ��������/mL | ||
�ζ�ǰ�̶� | �ζ���̶� | ��Һ���/mL | ||
��һ�� | 25.00 | |||
�ڶ��� | 25.00 | 1.56 | 28.08 | 26.52 |
������ | 25.00 | 0.22 | 26.34 | 26.12 |
��4��������ϱ���������ʽ���������������Һ�����ʵ���Ũ�ȣ�c��NaOH��= �� 
���𰸡�
��1����ƿ����Һ��ɫ�ı仯����Һ��ɫ�ɺ�ɫͻ��Ϊ��ɫ���Ұ�����ڲ���ɫ
��2��D
��3��0.00��26.10��26.10
��4��0.1044mol/L
���������⣺��1������к͵ζ�ʱ���۾�Ҫע����ƿ����Һ����ɫ�仯���ζ��յ�ʱ��Һ��ɫ�ɺ�ɫͻ��Ϊ��ɫ���Ұ�����ڲ���ɫ�����Դ��ǣ���ƿ����Һ��ɫ�ı仯����Һ��ɫ�ɺ�ɫͻ��Ϊ��ɫ���Ұ�����ڲ���ɫ����2��A����ʽ�ζ���δ�ñ�������Һ��ϴ��ֱ��ע���������Һ����Һ��Ũ��ƫС�����V������ƫ����c�����⣩= ![]() �������ⶨc�����⣩ƫ��A���� B���ζ�ǰʢ������������Һ����ƿ������ˮϴ����û�и������Һ�����ʵ������䣬��V��������Ӱ�죬����c�����⣩=
�������ⶨc�����⣩ƫ��A���� B���ζ�ǰʢ������������Һ����ƿ������ˮϴ����û�и������Һ�����ʵ������䣬��V��������Ӱ�죬����c�����⣩= ![]() �������ⶨc�����⣩��Ӱ�죬��B���� C����ʽ�ζ����ڵζ�ǰ�����ݣ��ζ���������ʧ�����V������ƫ����c�����⣩=
�������ⶨc�����⣩��Ӱ�죬��B���� C����ʽ�ζ����ڵζ�ǰ�����ݣ��ζ���������ʧ�����V������ƫ����c�����⣩= ![]() �������ⶨc�����⣩ƫ��C���� D����ȡ�������ʱ����ʼ���Ӷ������ζ�����ʱ���Ӷ��������V������ƫС������c�����⣩=
�������ⶨc�����⣩ƫ��C���� D����ȡ�������ʱ����ʼ���Ӷ������ζ�����ʱ���Ӷ��������V������ƫС������c�����⣩= ![]() �������ⶨc�����⣩ƫС����D��ȷ����ѡD�� ��3����ʼ����Ϊ0.00mL���յ����Ϊ26.10mL��������Һ�����Ϊ26.10mL�����Դ��ǣ�0.00��26.10��26.10����4���������ĵ���������Ϊ26.10mL��26.52mL��26.12mL���ڶ�����ȥ������������Һ��ƽ�����Ϊ26.11mL��NaOH��Һ�����Ϊ25.00mL��
�������ⶨc�����⣩ƫС����D��ȷ����ѡD�� ��3����ʼ����Ϊ0.00mL���յ����Ϊ26.10mL��������Һ�����Ϊ26.10mL�����Դ��ǣ�0.00��26.10��26.10����4���������ĵ���������Ϊ26.10mL��26.52mL��26.12mL���ڶ�����ȥ������������Һ��ƽ�����Ϊ26.11mL��NaOH��Һ�����Ϊ25.00mL��
HCl��NaOH
1 1
0.1000molL��1��26.11mL C��NaOH����25.00mL
��ã�C��NaOH��=0.1044mol/L��
���Դ��ǣ�0.1044mol/L��
�����㾫����������Ĺؼ�������������к͵ζ������֪ʶ�������к͵ζ�ʵ��ʱ��������ˮϴ���ĵζ������ñ�Һ��ϴ����װ��Һ�����ô���Һ��ϴ������ȡҺ�壻�ζ��ܶ���ʱ�ȵ�һ�����Ӻ��ٶ������۲���ƿ����Һ��ɫ�ĸı�ʱ���ȵȰ������ɫ�����Ϊ�ζ��յ㣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������HA��������NaA�Ļ����Һ���ڻ�ѧ������������Һ�������м�����������ʱ����Һ������Ա仯����
��1�������Һ�м�����������ʱ��������Ӧ�����ӷ���ʽ�� �� �����м�������KOH��Һʱ��������Ӧ�����ӷ���ʽ����
��2���ֽ�0.04molL��1HA��Һ��0.02molL��1NaOH��Һ�������ϣ��õ�������Һ��
����HAΪHCN������Һ�Լ��ԣ�����Һ��c��Na+��c��CN���������������=������������ó��ý��۵����������û����Һ�������غ�ʽ�� ��
����HAΪCH3COOH������Һ�����ԣ���Һ�����е����Ӱ�Ũ���ɴ�С���е�˳���� �� �û����Һ�������غ�ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��ԭ���װ�ã�X��YΪ�����缫���������ҺΪϡ���ᣬ���·�еĵ���������ͼ��ʾ���Դ�װ�õ�����������ȷ���ǣ� �� 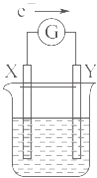
A.���·�еĵ�������Ϊ��X�����·��Y
B.�������缫�ֱ�ΪZn��̼������XΪ̼����YΪZn
C.�������缫���ǽ����������ǵĻ��ΪX��Y
D.X���Ϸ������ǻ�ԭ��Ӧ��Y���Ϸ�������������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס��ҡ�����λͬѧ�ֱ�������������ʵ�飮
ʵ��һ�����ᾧ�壨H2C2O4����Ũ�����ϻ�������ʱ���ɷ������·�Ӧ��H2C2O4=CO2��+CO��+H2O����ͬѧ�������ͼ1ʵ��װ�ã�������ȡ���﴿����CO���壬�������ɵ�CO���廹ԭFexOy �� ��ȡ���ۣ�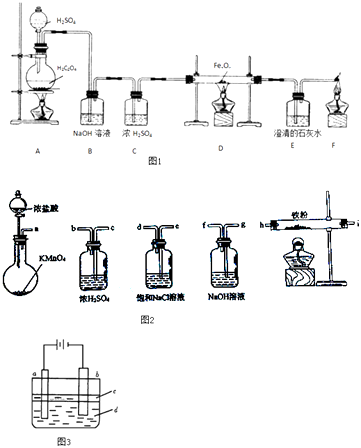
��1��װ��B�������� �� װ��E�е������� �� װ��F�������� ��
��2����FexOyΪ0.4g�����ɵ��������������ʯ��ˮ��Ӧ����0.75g��ɫ��������FexOy�Ļ�ѧʽΪ ��
ʵ�������ͬѧ����ͼ2��ʾ������ʵ�����Ʊ�������ˮFeCl3 �� ������������˳����������˳����� ��
ʵ��������ͬѧ����ͼ3ʵ��װ�ÿ��Ƶô�����Fe��OH��2�������������Ϸֱ�Ϊʯī������
��a�缫����Ϊ �� ��缫��ӦʽΪ ��
��Һ��cΪ������������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ���ǣ� ��
A.�Ȼ�����Һ�м��������ˮ��Ӧ��ʵ����Al3++3NH3?H2O�TAl��OH��3��+3NH ![]()
B.��������ˮ�е��ؽ������ӣ�����Ͷ�������ȵ���ʵķ������д���
C.þ���Ͻ�ȿ���ȫ���ڹ��������ֿ���ȫ���ڹ���NaOH��Һ
D.�������ȷ�Ӧԭ�����ܷ�����Ӧ2Al+3MgO ![]() 3Mg+Al2O3
3Mg+Al2O3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼����������ͬ�������ڵ�����Ԫ�أ�̼�����������仯��������������ͿƼ��ȷ�������Ҫ��Ӧ�ã���ش��������⣺
��1��̼���������ĵ�һ�������ɴ�С˳��Ϊ
��2��H2O������ԭ���ӻ�����ռ乹��Ϊ �� ��̬H2O�ľ�������Ϊ ��
��3���Ƚϼ��ǵĴ�С��H2OCH4���������������=������ԭ��Ϊ
��4��Ԫ��M��������NH4+����������������������ͬ����M��ԭ�ӽṹʾ��ͼΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijϡ��Һ�к���Fe��NO3��3��Cu��NO3��2��HNO3 �� �������������ۣ���Һ��Fe2+��Ũ����������۵����ʵ���֮��Ĺ�ϵ��ͼ��ʾ������Һ��Fe��NO3��3��Cu�� NO3��2��HN03���ʵ���Ũ��֮��Ϊ�������� 
A.1��1��1
B.1��3��1
C.2��1��4
D.1��1��4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������
��1��ij�����з�����һ����ѧ��Ӧ����Ӧ�����д���H2O��ClO����CN����HCO3����N2��Cl���������ӣ��ڷ�Ӧ�����в��ClO����N2�����ʵ�����ʱ��仯��������ͼ��ʾ�� 
�÷�Ӧ�����ӷ���ʽ�� ��
��2�������������Ǵ�����Ⱦ����Ҫ�����أ���NOxת��Ϊ�������ǵ�ǰ�о�����Ҫ���⣮
����ʽ��X����Ϊ����Ⱦ�����ʣ�ϵ��n����Ϊ0��
NO2+G ![]() N2+H2O+nX��δ��ƽ�ķ�Ӧʽ����
N2+H2O+nX��δ��ƽ�ķ�Ӧʽ����
���л������У�����������Ӧʽ�е�G������д��ĸ����
a��NH3 b��CO2 c��SO2 d��CH3CH2OH
����GΪ��Ȼ������Ҫ�ɷ֣���XΪ �� n= ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������250mLŨ��Ϊ2.0mol/L������ͺ�1mol�������Ƶ���Һ����������м��������ԭ������Al��OH��3�������ʱ������������Ϊ�� ��
A.26g
B.36g
C.104g
D.37.8g
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com