
【题目】在容积一定温度一定的密闭容器中发生反应M2(?)+2R2(g)M2R4(g),加入1mol M2和2molR2 , 反应过程中测得气体的平均相对分子质量随时间的变化如图所示.则下列说法错误的是( ) 
A.M2既可能为固体,也可能为气体
B.达到平衡后,保持容器容枳和温度不变,再加入1molM2和2molR2 , 则R2转化率不变
C.达到平衡后,保持温度不变,将容器容积压缩到原来的一半,当达到新的平衡时,R2的浓度可能是原平衡时的1.8倍
D.若M2为气体,达到平衡后,保持容器容积和温度不变,再加入1molM2R4 , 则新的平衡时气体的平均相对分子质量增大
【答案】B
【解析】解:A、如果M2为固体,随反应的进行,气体的质量增加,物质的量减小,所以混合气体的相对分子质量增大;如果M2为气体,气体的质量不变,物质的量减小,所以混合气体的相对分子质量增大,达平衡后不变,故A正确; B、再加入1molM2和2molR2 , 相当于增大压强,平衡正向移动,则R2转化率变大,故B错误;
C、达到平衡后,保持温度不变,将容器容积压缩到原来的一半,增大压强,平衡正向移动,如果不移动,R2的浓度可能是原平衡时的2倍,平衡正向移动,所以R2的浓度小于2倍,所以可能是1.8倍,故C正确;
D、若M2为气体,达到平衡后,保持容器容积和温度不变,再加入1molM2R4 , 等效于增大压强,平衡正向移动,气体的质量不变,物质的量减小,所以混合气体的相对分子质量增大,故D正确;
故选B.
A、如果M2为固体,随反应的进行,气体的质量增加,物质的量减小,所以混合气体的相对分子质量增大;如果M2为气体,气体的质量不变,物质的量减小,所以混合气体的相对分子质量增大;
B、再加入1molM2和2molR2 , 相当于增大压强;
C、达到平衡后,保持温度不变,将容器容积压缩到原来的一半,增大压强,平衡正向移动,如果不移动,R2的浓度可能是原平衡时的2倍,平衡正向移动,所以R2的浓度小于2倍;
D、若M2为气体,达到平衡后,保持容器容积和温度不变,再加入1molM2R4 , 等效于增大压强,平衡正向移动;


科目:高中化学 来源: 题型:
【题目】下列物质的沸点由高到低排列的是( ) ①CH3(CH2)2CH3
②CH3(CH2)3CH3
③(CH3)3CH
④(CH3)2CHCH2CH3 .
A.②④①③
B.④②③①
C.④②①③
D.②④③①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意填空
(1)室温下,0.1 mol/L NaClO溶液的pH0.1 mol/L Na2SO3溶液的pH. (选填“大于”、“小于”或“等于”).浓度均为0.1 mol/L 的Na2SO3和Na2CO3的混合溶液中,SO32﹣、CO32﹣、HSO3﹣、HCO3﹣ 浓度从大到小的顺序为 .
已知:H2SO3 K1=1.54×10﹣2 K2=1.02×10﹣7 HClO K1=2.95×10﹣8
H2CO3 K1=4.3×10﹣7 K2=5.6×10﹣11
(2)用标准碘溶液滴定容有SO2的水溶液,以测定水中SO2的含量,应选用作指示剂,达到滴定终点的现象是 .
(3)常温下,将amol/lCH3COONa溶于水配成溶液,向其中滴加等体积bmolL﹣1的盐酸使溶液呈中性(不考虑醋酸和盐酸的挥发),用含a和b的代数式表示醋酸的电离平衡常数Ka= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知32 g X与40 g Y恰好完全反应,生成m g Q和 9 g H,在相同条件下,16 g X和足量Y混合生成0.25 mol Q和若干摩的H,则物质Q的摩尔质量应是( )
A. 122 g·mol-1 B. 63 g·mol-1 C. 126 g·mol-1 D. 163 g·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既不是氧化剂也不是还原剂等。下列反应与C+H2O(g)![]() CO+H2相比较,水的作用相同的是 ( )
CO+H2相比较,水的作用相同的是 ( )
A. 3NO2+H2O=2HNO3+NO B. Na2O+H2O=2NaOH
C. 2F2+2H2O=4HF+O2 D. 3Fe+4H2O(g)![]() Fe3O4+4H2
Fe3O4+4H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(g)+5O2(g)═4NO(g)+6H2O(g) 在2L的密闭容器中进行,1分钟后,NH3减少了0.12mol,则平均每秒钟各物质浓度变化正确的是( )
A.NH3:0.002 molL﹣1
B.H2O:0.002 molL﹣1
C.NO:0.001 molL﹣1
D.O2:0.001 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率是化学反应原理的重要组成部分.请回答下列问题:
(1)已知一定条件下发生反应:2SO2(g)+O2(g)2SO3(g)△H<0,在反应过程中,正反应速率的变化如图所示,请根据速率的变化回答采取的措施(改变的条件). 
(2)探究反应条件对0.l0mol/L,Na2S2O3溶液与稀H2SO4反应速率的影响.其设计与测定结果如表:
编号 | 反应温度/℃ | Na2S2O3浓液/mL | 甲 | 0.1mol/LH2SO4溶液/mL | 乙 |
① | 25℃ | 10.0 | 0 | 10.0 | |
② | 25℃ | 5.0 | a | 10.0 | |
③ | 45℃ | 10.0 | 0 | 10.0 |
上述实验①③是探究对化学反应速率的影响;若上述实验①②是探究浓度对化学反应速率的影响,则表格中“甲”为 , a为;乙是实验需要测量的物理量,则表格中“乙”为 .
(3)已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大. ①针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大.从影响化学反应速率的因素看,你猜想还可能是的影响.
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入(填字母序号).
A.硫酸钾B.氯化锰c.硫酸锰D.水.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH的物质的量(mol)和所得沉淀的物质的量(mol)的关系如下图所示。
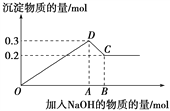
(1)写出代表各线段发生的反应的离子方程式:
OD段________________________________________________,
DC段________________________________________________。
(2)原溶液中Mg2+、Al3+的物质的量浓度之比为________。
(3)图中C点表示当加入______mol NaOH时,Al3+已经转化为_____,Mg2+已经转化为______。
(4)图中线段OA∶AB=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学学习小组对某镁铝合金进行了如下实验研究,请你参与并完成有关问题。
【实验药品】:
12.6g镁铝合金,200ml a mol/L稀硫酸,520ml 4 mol/L NaOH溶液。
【实验步骤】:
①将12.6g镁铝合金与200mL a mol/L的稀硫酸在如图所示装置中充分反应至反应完毕,并收集生成的全部气体。

②向b内的混合液中逐滴加入520ml 4 mol/L氢氧化钠溶液并充分混合,当氢氧化钠溶液加至500mL时生成的沉淀量最大。
【问题讨论】:
(1)仪器b的名称是___________________。
(2)根据实验目的可知,12.6g镁铝合金与200mL a mol/L的稀硫酸反应时,应该过量的物质是____________(填“镁铝合金”或“稀硫酸”),以保证另一种物质能够完全反应无剩余;若标准状况下,由实验步骤①得到的气体为13.44L,则合金中镁的质量分数为__________________________(保留到0.1%)。
(3)实验步骤②中,当b内混合液中因滴加氢氧化钠溶液至生成的沉淀量最大时,此时所得溶液中的溶质是__________________(填化学式)。
(4)实验步骤①结束后,读取量筒所呈现的数据时,需要注意的三个问题是:一是要冷却到室温,二是要_____________________________,三是要视线与量筒内的凹液面相平。
(5)在“a mol/L稀硫酸”中的a的值为_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com