
 C(g) +3D(g) △H<0。该可逆反应的反应速率—时间、转化率—时间关系图如下,下列分析中错误的是( )
C(g) +3D(g) △H<0。该可逆反应的反应速率—时间、转化率—时间关系图如下,下列分析中错误的是( )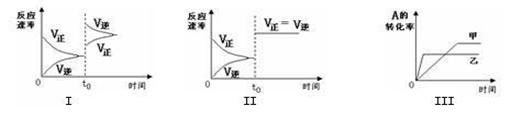
| A.图I可体现t0时升高温度对反应速率的影响 |
| B.图II可体现t0时增大压强(缩小体积)或使用催化剂对反应速率的影响 |
| C.图III可体现温度对化学平衡的影响,且乙的温度较高 |
| D.图III可体现催化剂对化学平衡的影响,且甲使用了催化剂 |
科目:高中化学 来源:不详 题型:填空题
 CO2 (g) 十 H2 (g) ; △H<0
CO2 (g) 十 H2 (g) ; △H<0
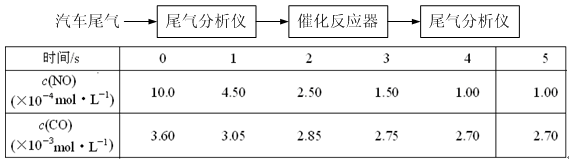
 CO2 (g) + H2 (g)的平衡浓度符合c(CO2)·c(H2)=2 c(CO)·c(H2O),则t2℃ 850℃,判断依据是:
CO2 (g) + H2 (g)的平衡浓度符合c(CO2)·c(H2)=2 c(CO)·c(H2O),则t2℃ 850℃,判断依据是: 查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
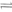 2c(g),△H<0;达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是
2c(g),△H<0;达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是| | X | Y |
| A | 再加入B | B的转化率 |
| B | 再加入C | A的体积分数 |
| C | 增大压强 | A的转化率 |
| D | 升高温度 | 混合气体平均摩尔质量 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 Fe(SCN)2+ 来检验反应是否产生铁离子。已知在一定温度下该反应达到平衡时c(Fe3+)="0.04" mol/L,c(SCN—)=0.1mol/L,c[Fe(SCN)2+]=0.68mol/L,则此温度下该反应的平衡常数K= 。
Fe(SCN)2+ 来检验反应是否产生铁离子。已知在一定温度下该反应达到平衡时c(Fe3+)="0.04" mol/L,c(SCN—)=0.1mol/L,c[Fe(SCN)2+]=0.68mol/L,则此温度下该反应的平衡常数K= 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:| A.①③ | B.①④ | C.②③ | D.③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 B + D在不同条件下进行,B、D的起始浓度为0,把反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表所示。
B + D在不同条件下进行,B、D的起始浓度为0,把反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表所示。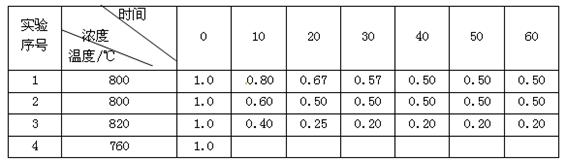
 www.k@s@5
www.k@s@5 @u.com
@u.com 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.实验室用排水法收集氯气时用饱和食盐水代替水以减少氯气的溶解 |
| B.氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深 |
| C.实验室保存硫酸亚铁溶液时加入几枚铁钉以防止试剂变质 |
| D.在二氧化硫的催化氧化反应中,通入过量的空气以提高二氧化硫的转化率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com