
| A、向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO3-) |
| B、0.1 mol?L-1 NH4Cl溶液:c(NH4+)=c( Cl-) |
| C、向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D、1.0×10-3 mol/L盐酸的pH=3.0,1.0×10-8 mol/L盐酸的pH=8.0 |


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
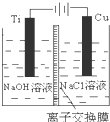 纳米级Cu2O由于具有优良的催化性能而受到关注,如表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,如表为制取Cu2O的三种方法:| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法:2Cu+H2O Cu2O+H2↑ |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
| 光照 |
| CU2O |
| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:
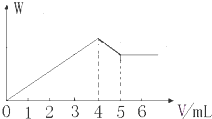 现有Al2(SO4)3和MgCl2的混合溶液,向其中逐滴加入NaOH溶液,得到沉淀的物质的量(W)与加入NaOH溶液的体积关系如图所示,则原溶液中SO42-与Cl-的物质的量之比为( )
现有Al2(SO4)3和MgCl2的混合溶液,向其中逐滴加入NaOH溶液,得到沉淀的物质的量(W)与加入NaOH溶液的体积关系如图所示,则原溶液中SO42-与Cl-的物质的量之比为( )| A、1:1 | B、3:2 |
| C、2:3 | D、2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从I2的CCl4溶液中得到CCl4,可用蒸馏法 |
| B、从Na2CO3溶液中得到Na2CO3,可用过滤法 |
| C、分离水和CCl4的混合物,可用蒸馏法 |
| D、分离NaCl和AgCl的混合物,可用萃取法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2NaClO+H2O+CO2═Na2CO3+2HClO |
| B、Ca(ClO)2+2H2O+2CO2═Ca(HCO3)2+2HClO |
| C、NaClO+H2O+CO2═NaHCO3+HClO |
| D、Ca(ClO)2+2HCl═CaCl2+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化性:ClO->I2>SO42- |
| B、蓝色消失的原因是Na2SO3溶液具有漂白性 |
| C、淀粉-KI溶液变蓝是因为I-被ClO-氧化为I2,I2使淀粉变蓝 |
| D、若将Na2SO3溶液加入氯水中,氯水褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com