
| A. | 氧化还原反应:元素化合价是否变化 | |
| B. | 共价化合物:是否含有共价键 | |
| C. | 强弱电解质:溶液的导电能力大小 | |
| D. | 氧化物:含氧化合物 |
分析 A.有元素化合价变化的反应一定为氧化还原反应;
B.含有共价键的化合物不一定为共价化合物;
C.溶液的导电能力以离子的浓度和电荷有关;
D.两种元素组成其中一种为氧元素的化合物为氧化物.
解答 解:A.化合价的变化为氧化还原反应的特征,则有元素化合价变化的反应一定为氧化还原反应,故A正确;
B.含有共价键的化合物不一定为共价化合物,如NaOH中含有共价键,但属于离子化合物,故B错误;
C.因溶液的导电能力以离子的浓度和电荷有关,强弱电解质与电离程度有关,二者没有必然的联系,故C错误;
D.含氧化合物不一定是氧化物,如含氧酸,只有两种元素组成,其中一种为氧元素的化合物为氧化物,故D错误;
故选A.
点评 本题考查知识点较多,但多为基础知识,注重对学生基础知识的考查,明确有关的概念即可解答,题目难度不大.


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | 只有④ | D. | 全部不是 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
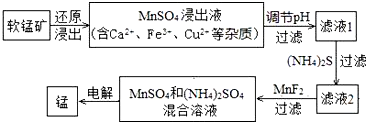
| 物质 | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
| pKsp | 37.4 | 19.32 | 5.26 | 12.7 | 35.2 | 5.86 | 12.6 | 10.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1molNa2O2与水反应转移电子数为0.1 NA | |
| B. | 标准状况下,11.2L HF含有的分子数为0.5 NA | |
| C. | 1mol S在足量O2中燃烧,转移的电子数为6 NA | |
| D. | 7.8g Na2O2固体中所含阴离子数为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①和② | B. | ② | C. | ③和④ | D. | 以上都不对 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢键是化学键 | |
| B. | 甲烷可与水形成氢键 | |
| C. | 乙醇分子跟水分子之间存在范德华力和氢键 | |
| D. | 碘化氢的沸点比氯化氢的沸点高是由于碘化氢分子之间存在氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
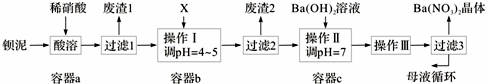
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
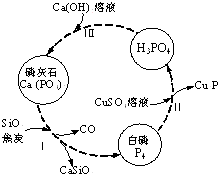 氮、磷及其化合物在科研及生产中均有着重要的应用.
氮、磷及其化合物在科研及生产中均有着重要的应用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com