
元素的性质呈现周期性变化的根本原因是( )
A.原子半径呈周期性变化
B.元素的化合价呈周期性变化
C.元素原子的核外电子排布呈周期性变化
D.第一电离能呈周期性变化
科目:高中化学 来源: 题型:
在一密闭容器中发生反应N2+3H22NH3,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。
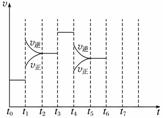
回答下列问题:
(1)处于平衡状态的时间段是________(填选项,下同)。
A.t0~t1 B.t1~t2 C.t2~t3
D.t3~t4 E.t4~t5 F.t5~t6
(2)判断t1、t3、t4时刻分别改变的一个条件。
A.增大压强 B.减小压强 C.升高温度
D.降低温度 E.加催化剂 F.充入氮气
t1时刻________;t3时刻________;t4时刻________。
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是__________。
A.t0~t1 B.t2~t3
C.t3~t4 D.t5~t6
(4)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化曲线。
(5)一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20%,则反应后与反应前的混合气体体积之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)在25 ℃时,HSCN、HClO、H2CO3的电离常数如下表:
| HClO | HSCN | H2CO3 |
| K=3.2×10-8 | K=0.13 | K1=4.3×10-7 K2=5.6×10-11 |
①1 mol·L-1的KSCN溶液中,所有离子的浓度由大到小的顺序为________________________________________________________________________。
②向Na2CO3溶液中加入过量HClO溶液,反应的化学方程式为____________________。
③25 ℃时,为证明HClO为弱酸,某学习小组的同学设计了以下三种实验方案。下列三种方案中,你认为能够达到实验目的的是______(填字母)。
a.用pH计测量0.1 mol ·L-1 NaClO溶液的pH,若测得pH>7,可证明HClO为弱酸
b.用pH试纸测量0.01 mol·L-1HClO溶液的pH,若测得pH>2,可证明HClO为弱酸
c.用仪器测量浓度均为0.1 mol·L-1的HClO溶液和盐酸的导电性,若测得HClO溶液的导电性弱于盐酸,可证明HClO为弱酸
(2)①肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。联氨溶于水可以发生与氨水类似的电离,试写出联氨在水溶液中的电离方程式:_______ (写一步即可)。
②NH 在溶液中能发生水解反应。在25 ℃时,0.1 mol·L-1的氯化铵溶液由水电离出的氢离子浓度为1×10-5mol·L-1,则在该温度下此溶液中氨水的电离平衡常数Kb(NH3·H2O)=______。
在溶液中能发生水解反应。在25 ℃时,0.1 mol·L-1的氯化铵溶液由水电离出的氢离子浓度为1×10-5mol·L-1,则在该温度下此溶液中氨水的电离平衡常数Kb(NH3·H2O)=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
NA代表阿伏伽德罗常数。已知C2H4和C3H6的混合物的质量为ag,则该混合物( )
A.所含共用电子对数目为(a/7+1)NA B.所含碳氢键数目为aNA/7
C.燃烧时消耗的O2一定是33.6a/14L D.所含原子总数为aNA/14
查看答案和解析>>
科目:高中化学 来源: 题型:
苯甲酸广泛应用于制药和化工行业,某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸(KMnO4中性条件下还原产物为MnO2,酸性条件下为Mn2+)
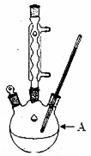
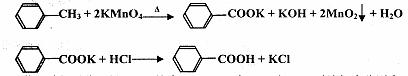
已知:苯甲酸相对分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3 g和6.9 g。
实验流程:
①往装置A中加入2.7mL(2.3 g)甲苯和125 mL水,然后分批次加入8.5 g稍过量的KMnO4固体,控制反应温度约在100℃,当甲苯层近乎消失,回流不再出现油珠时,停止加热。
②将反应混合物趁热过滤,用少量热水洗涤滤渣,合并滤液与洗涤液,冷却后加入浓盐酸,经操作I得白色较干燥粗产品。
③纯度测定:称取1.220g白色样品,配成100mL苯甲酸溶液,取25.00mL溶液,用0.1000mol/L KOH标准溶液滴定,重复滴定四次,每次消耗的体积如下表所示。

请回答:
(1)装置A的名称 。若不用温度计,本实验控制反应温度的措施为 。
(2)白色粗产品中除了KCl外,其他可能的无机杂质为____ 。
(3)操作②中趁热过滤的目的是 ,
操作I的名称 。
(4)步骤③中用到的定量仪器有分析天平, ,50mL酸式、碱式滴定管。
(5)样品中苯甲酸纯度为 。
(6)滴定操作中,如果对装有KOH标准溶液的滴定管读数时,滴定前仰视,滴定后俯视则测定结果将 (填“偏大”、“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列现象与氢键有关的是( )
①NH3的熔沸点比第ⅤA族相邻元素的氢化物高
②NH3易溶于水
③冰的密度比液态水的密度小
④尿素的熔沸点比醋酸的高
⑤邻羟基苯甲酸的熔沸点比对羟基苯甲酸的低
⑥水分子高温下也很稳定
A.①②③④⑤⑥ B.①②③④⑤
C.①②③④ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
氯化硼的熔点为10.7 ℃,沸点为12.5 ℃。在氯化硼分子中,氯—硼—氯键角为120°,它可以水解,水解产物之一是氯化氢。下列对氯化硼的叙述中正确的是( )
A.氯化硼是原子晶体
B.熔化时,氯化硼能导电
C.氯化硼是一种离子晶体
 D.水解方程式:BCl3+3H2O H3BO3+3HCl
D.水解方程式:BCl3+3H2O H3BO3+3HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2,发生如下反应:2SO2(g)+O2(g)2SO3(g) ΔH<0。2 min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量Q kJ,则下列分析正确的是( )
A.在该条件下,反应前后的压强之比为1∶1
B.若反应开始时容器容积为2 L,则v(SO3)=0.35 mol·L-1·min-1
C.若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)<1.4 mol
D.若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量大于Q kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
现将氯化铝溶液蒸干灼烧并熔融后用铂电极进行电解,下列有关电极产物的判断正确的是( )
A.阴极产物是氢气
B.阳极产物是氧气
C.阴极产物是铝和氧气
D.阳极产物只有氯气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com