
【题目】铁、钴、镍及其化合物有许多用途。回答下列问题:
(1)基态铁原子核外共有____________种不同空间运动状态的电子,铁、钴、镍基态原子核外未成对电子数最少的价层电子的电子排布图(轨道表达式)为_________________。
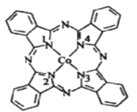
(2)酞菁钴分子的结构简式如图所示,分子中与钴原子通过配位键结合的氮原子的编号是______(填“1”“2”“3”或“4”),分子中三种非金属原子的电负性由大到小的顺序为____________(用相应的元素符号表示),分子中碳原子的杂化轨道类型为____________。
(3)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,该晶体固态下不导电,熔融状态、水溶液均能导电,该晶体属于____(填晶体类型)。配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为16,则x=___。
(4)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和74pm,则熔点NiO____FeO(填“>”“<”或“=”),原因是______。
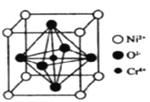
(5)Ni、O、Cr可以形成一种具有特殊导电性的复合氧化物,晶胞结构如图所示,晶胞边长为apm,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为_______g·cm-3.。
【答案】15 ![]() 2、4 N>C>H sp2 离子晶体 4 > 相同电荷的离子,半径越小,离子键越强,晶格能就越大,熔点就越高
2、4 N>C>H sp2 离子晶体 4 > 相同电荷的离子,半径越小,离子键越强,晶格能就越大,熔点就越高 ![]() ×1030
×1030
【解析】
(1)铁为26号元素,基态铁原子核外电子排布式为:1s22s22p63s23p63d64s2,其核外有 26种不同运动状态的电子,有1s、2s、 3s、 4s、 2p、 3p、 3d共15种不同空间运动状态的电子;铁、钴、镍的价电子排布式分别为3d64s2、3d74s2、 3d84s2,基态原子核外未成对电子数最少的是Ni,价层电子的电子排布图为![]() ;
;
答案为:15; ![]() ;
;
(2)含有孤对电子的N原子与Co通过配位键结合,形成配位键后有4对共用电子对,形成3对共用电子对的N原子形成普通的共价键, 1号、3号N原子形成3对共用电子对为普通共价键,2号、4号N原子形成4对共用电子对,与Co通过配位键结合;酞菁钴中三种非金属原子为C、N、H,同周期自左而右电负性增大,非金属性越强电负性越大,故电负性N>C>H;根据分子结构简式,其中碳原子在苯环上或形成碳碳双键,因此碳原子为sp2杂化。答案为:2、4;N>C>H;sp2 ;
(3)离子晶体固体中离子不能自由移动而不能导电,而熔融状态下可以电离出自由移动的离子可以导电;由高铁酸钾晶体固体下不导电,熔融状态、水溶液均可导电可知,该晶体为离子晶体;配合物Fe(CO)的中心原子为Fe,其价电子数为8,每个配体是供的电子数为2 ,则可得等式8+2x=16,解得x=4;
答案为:离子晶体; 4;
(4)NiO、 FeO的晶体结构类型均与NaCI相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,晶格能越大,熔点越高,由于Ni2+的离子半径小于Fe2+的离子半径,所以熔点是NiO>FeO;
答案为:>;相同电荷的离子,半径越小,离子键越强,晶格能就越大,熔点就越高;
(5)根据晶胞结构图和均摊法可知,晶胞中O原子数为6×![]() =3,Ni原子数为8×
=3,Ni原子数为8×![]() =1, Cr原子为1 ,则化学式为NiCrO3,晶胞变长为a pm,阿伏伽德罗常数值为NA ,则有
=1, Cr原子为1 ,则化学式为NiCrO3,晶胞变长为a pm,阿伏伽德罗常数值为NA ,则有![]() ,则晶体的密度
,则晶体的密度![]()
答案为:![]() ×1030;
×1030;


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】乙醇分子结构中各种化学键如图所示,关于乙醇在各种反应中断键的说明不正确的
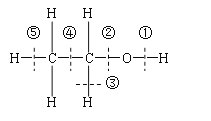
A.和金属钠反应是键①断裂
B.和浓氢溴酸混合加热时断键②
C.和浓硫酸共热到170℃时断键②和⑤
D.和浓硫酸共热到140℃时仅断键②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置进行的相应实验,能达到实验目的的是( )
A. 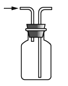 收集 NOB.
收集 NOB.  制备 NH3
制备 NH3
C.  制备 Fe(OH)2D.
制备 Fe(OH)2D. 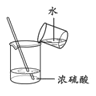 稀释浓 H2SO4
稀释浓 H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】侯德榜是我国著名的工业化学家,又是一个伟大的爱国者,他所发明的制碱法为中国化学工业乃至世界化学工业做出了重要的贡献,被誉为“侯氏制碱法”。请你回答以下问题:
(1)某同学为了验证NaHCO3和Na2CO3的稳定性,设计了如图的实验装置(铁架台、夹持仪器、加热装置等已省略):
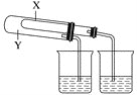
你认为在X中应放的物质是__(填化学式)。
(2)某化学研究性学习小组在老师的指导下,模拟侯德榜先生制碱原理设计了如图的实验装置。
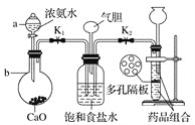
①写出有关仪器的名称:a__,b__。
②实验的操作步骤中,你认为打开旋塞K1、K2的合理顺序应为先打开__,后打开__(填字母代号)。简述理由___。
③在盛饱和食盐水的装置中发生反应的离子方程式为__;装置中气胆的作用是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋(Bi)位于元素周期表中VA族,其价态为+3时较稳定,铋酸钠(NaBiO3)溶液呈无色。现取一定量的硫酸锰(MnSO4)溶液,向其中依次滴加下列溶液,对应的现象如表所示:

则NaBiO3、KMnO4、I2、H2O2的氧化性由强到弱的顺序为( )
A. I2、H2O2、KMnO4、NaBiO3B. H2O2、I2、NaBiO3、KMnO4
C. NaBiO3、KMnO4、H2O2、I2D. KMnO4、NaBiO3、I2、H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的检验中,其结论一定正确的是( )
A.某溶液为蓝色,则该溶液一定是CuSO4溶液
B.向某溶液中加入Ba(NO3)2溶液无明显现象,再滴入几滴硝酸酸化的AgNO3溶液,产生白色沉淀,说明原溶液中含有Cl-
C.向某溶液中加入CaCl2溶液,产生白色沉淀,则溶液中一定含有Ag+
D.加入稀HNO3酸化的BaCl2溶液,有白色沉淀生成,证明原溶液中一定有SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2Fe2++Cl2=2Cl﹣+2Fe3+,2Br﹣+Cl2=Br2+2Cl﹣,2Fe2++Br2=2Br﹣+2Fe3+。在bL FeBr2溶液中通入amol Cl2时,使溶液中50% 的Br﹣氧化为Br2,则原FeBr2的物质的量浓度为
A. a/bmolL﹣1 B. 2a/bmolL﹣1 C. 3a/bmolL﹣1 D. 5a/bmolL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是向MgCl2、AlCl3混合溶液中,开始滴加7mL试剂A,之后改滴试剂B,所得沉淀y(mol)与试剂体积V(mL)间的关系.以下结论不正确的是( )

A. A是NaOH,B是盐酸,且c(NaOH)︰c(HCl)=2︰1
B. 原混合液中,c(Al3+)︰c(Mg2+)︰c(Cl-)=1︰1︰5
C. A是NaOH,B是盐酸,且c(NaOH)︰c(HCl)=1︰2
D. 从6到9,相应离子反应式H+ + OH-===H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是生活中常见的金属,请回答下列问题:
(1)Cu不活泼,通常情况下不与稀硫酸反应,但向Cu和稀硫酸的混合物中滴入H2O2溶液后,溶液很快变蓝色,试写出该反应的离子方程式_____________________________________________________________。
(2)将硫酸铜溶液和碳酸钠溶液混合,会析出Cu2(OH)2CO3绿色固体,试写出该反应的离子方程式________________________________。
(3)火法炼铜的原理:Cu2S+O2高温,2Cu+SO2,在该反应中每生成1 mol Cu,转移________mol e-。
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是________(填选项字母)。
a.粗铜接电源正极,发生氧化反应
b.溶液中Cu2+向阴极移动
c.电解过程中,阳极和阴极的质量变化相等
d.利用阳极泥可回收Al、Zn等金属
(5)据报道,有一种叫Thibacillus Ferroxidans的细菌在有氧气存在的酸性溶液中,可将黄铜矿中CuFeS2氧化成硫酸盐:4CuFeS2+2H2SO4+17O2===4CuSO4+2Fe2(SO4)3+2H2O。利用反应后的溶液,按如下流程可制备胆矾(CuSO4·5H2O):
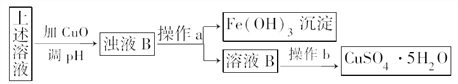
①检验溶液B中Fe3+是否被除尽的实验方法___________________________________________。
②在实验室中,设计两个原理不同的方案,从溶液B中提炼金属铜(要求:一种方案只用一个反应来完成)。写出两种方案中涉及的化学方程式
方案一:___________________________________________;
方案二:______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com