
10������������Ϊ98%.�ܶ�Ϊ1.84 g/ml��Ũ����������500ml0.2mol/l��ϡ���ᣬ�ɹ�ѡ����������£��ٲ���������ƿ���ձ��ܽ�ͷ�ιܢ���Ͳ������ƿ��������ƽ��ҩ�� ��ش��������⡣
��1�����������У�������ϡ����ʱ�ò����������� ?? ������ţ�
��2�������㣬��Ũ��������Ϊ �����Т�10ml.��50ml.��100ml���ֹ�����Ͳ����ѡ�õ���Ͳ��?? ������ţ�
��3����Ũ����ϡ�ͺ���ȴƬ�̣����ȫ��ת�Ƶ� ml������ƿ�У�ת��ʱӦ�ò����� ��ת����Ϻ�����������ˮϴ���ձ�������2~3�Σ�����ϴ��ҺҲת������ƿ�У��ڼ���������ˮֱ��Һ��ӽ����� �������� �μ�����ˮ��ƿ���̶ȵĵط�������Һ��ҡ�Ⱥ�װƿ����ǩ��
(4)��������������Ƶ�ϡ����Ũ���к�Ӱ�죿����ƫ�ߡ�ƫ�͡���Ӱ����д��
A������ƿ������ˮϴ�Ӻ�δ����_________________��
B�����õ�Ũ���᳤ʱ������ڳ���������_________________��
C������ʱ������Һ�İ�Һ��_________________��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| �¶�/�� | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| �ܽ�ȣ�g/100gH20�� | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
| 162.5cV |
| m |
| 162.5cV |
| m |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| �¶�/�� | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| �ܽ�ȣ�g/100gH20�� | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
| 162.5cV |
| m |
| 162.5cV |
| m |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
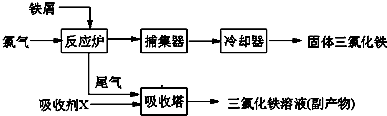
�Ȼ����dz�����ˮ����������ˮFeCl3���۵�Ϊ555K���е�Ϊ588K����ҵ���Ʊ���ˮFeCl3��һ�ֹ������£�
��1����д���������з�Ӧ�����ӷ���ʽ��____________________________��
��2����֪��ˮ���Ȼ�����ˮ�е��ܽ�����£�
| �¶�/�� | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| �ܽ��(g/100gH20) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
��FeCl3��Һ�л��FeCl3��6H2O�ķ����ǣ� ��
��3������ʱ��FeCl3��Һ�еμ�NaOH��Һ������ҺpHΪ2.7ʱ��Fe3+��ʼ����������ҺpHΪ4ʱ��c(Fe3+)= mol/L����֪��Ksp[Fe(OH)3]=1.1��10��36����
��4��FeCl3����������ͨ�����õ������ⶨ����ȡm����ˮ�Ȼ�����Ʒ������ϡ���ᣬ��ת�Ƶ�100mL����ƿ��������ˮ���ݣ�ȡ��10mL�������Թ�����KI��Һ����ַ�Ӧ����ijһָʾ������c mol/L Na2S2O3��Һ�ζ���ȥV mL��
�� ��֪��2Fe3+ +2I��= I2 +2Fe2+ I2+2S2O32��=2I�� +S4O62����
�ٵζ��յ�������ǣ�____________________________��
����Ʒ���Ȼ�������������Ϊ__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ�����ʡ�����и���Ԫ�µ�һ�ε��п������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
̼��Ƴ����������Ħ������ijͬѧ�����һ���Ʊ�̼��Ƶķ�����������ͼ���£�������ʯ��ʯ��������SiO2��

�ش��������⣺
��1���������110��ʯ��ʯ�õ�����66�֣���״�������ɶ�����̼�����Ϊ L��ʯ��ʯ��̼��Ƶ���������Ϊ %��
��2������ڢٲ���Ӧ��ȫ���У���ڢڲ���Ӧ���˺�õ��IJ����������ijɷ�Ϊ ��
��3���ڢ۲���Ӧһ�㲻����ͨ��CO2����Ҫԭ���� ����Ӧ�����ӷ���ʽΪ ��
��4��CaCO3��һ������Һ���ʣ�25��ʱ��KSP=2.8��10-9���ֽ��������CaCl2��Һ��Na2CO3��Һ��ϣ���Na2CO3��Һ��Ũ��Ϊ2.0��10-4mol/L�������ɳ�������CaCl2��Һ�����ʵ���Ũ����С�� ��
��5��ijѧ����ʯ��ʯΪԭ�ϣ��������һ���Ʊ�̼��Ƶ�ʵ�鷽����������ͼ���£�

��ǰһ������Ƚϣ��÷������ŵ��� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com