
某溶液中含有K+、Mg2+、Al3+、Cu2+等离子,为了将它们一一分离(不要求各离子恢复到原来的形态),某同学设计了如下四个实验方案,其中不正确的是[已知:Mg2+、Al3+溶液中通入H2S不产生沉淀;Ksp(CuS )=1.3×10-36。]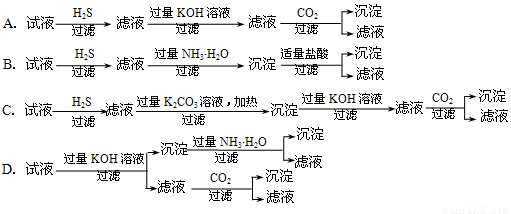
B
【解析】
试题分析:A选项依次沉淀分离出Cu2+,Mg2+,Al3+,最后滤液中剩余的是K+,正确。B选项氢氧化铝沉淀不能溶于氨水,即氢氧化镁与氢氧化铝不能分离开,故B不正确;C选项,先沉淀Cu2+,然后沉淀Mg2+,加入过量氢氧化钾,生成偏铝酸根离子,通入二氧化碳,发生双水解,Al3+被沉淀,滤液中最终剩余K+;D选项,加入过量氢氧化钾,沉淀里有Mg(OH)2和Cu(OH)2沉淀,加入过量氨水,Cu(OH)2沉淀溶解形成铜铵溶液,二者分离开了,向第一次得到的滤液中通入二氧化碳,发生双水解,Al3+被沉淀,滤液中最终剩余K+,所有离子均分离开。
考点:离子的沉淀与分离
点评:本题考查离子的沉淀与分离,其中重点在于试剂的滴加顺序与性质,理清每一步中物质之间的转化和关系是关键。难度较大。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
| A、Na+ |
| B、S2- |
| C、Mg2+ |
| D、Ba2+ |
查看答案和解析>>
科目:高中化学 来源:2015届云南省高一下学期期中考试化学文科卷(本部)(解析版) 题型:填空题
现有部分短周期元素的性质或原子结构如下表:
|
元素编号 |
元素性质或原子结构 |
|
T |
M层上电子数是K层上电子数的3倍 |
|
X |
最外层电子数是次外层电子数的2倍 |
|
Y |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
|
Z |
元素最高正价是+7价 |
(1)元素X位于元素周期表的第______________周期第________族,它的一种核素可测定文物年代,这种核素的符号是________。
(2)元素Y的原子结构示意图为______________,与氢元素形成一种离子YH,写出某溶液中含有该微粒的检验方法___________________________________________________。
(3)元素Z与元素T相比,非金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________。
a.常温下Z的单质和T的单质状态不同 b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
查看答案和解析>>
科目:高中化学 来源:2014届湖北省襄阳市四校高一上学期期中考试化学试卷 题型:选择题
某溶液中含有Cl-、SO42-、Fe3+、K+、M,且离子物质的量之比为2∶3∶1∶3∶2,则微粒M可能为 ( )
A.Na+ B.Ag+ C.Ba2+ D.Mg2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com