
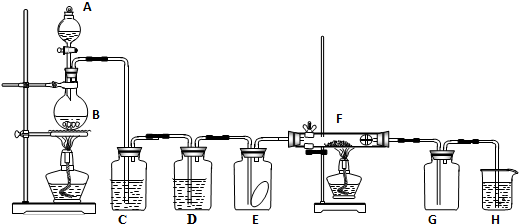
分析 分液漏斗中的浓盐酸滴入烧瓶B中的二氧化锰固体中加热发生反应生成氯气,氯气中含水蒸气和氯化氢气体杂质,通过装置C中饱和食盐水除去氯化氢气体,通过装置D中 的浓硫酸除去水蒸气,通过装置E检验干燥的氯气是否具有漂白性,通过装置F中的铜网加热发生反应生成棕黄色的烟得到氯化铜,通过装置G收集氯气,剩余氯气通过装置H中 的氢氧化钠溶液吸收,
(1)依据实验室是利用二氧化锰和浓盐酸加热反应生成氯气书写化学方程式;
(2)用饱和食盐水除去氯气中的氯化氢;装置D中为浓硫酸除去氯气中的水蒸气;
(3)E瓶中放有干燥红色布条,通入干燥氯气后不会褪色;E是铜加热和氯气反应生成氯化铜的反应,生成的氯化铜形成棕色烟;
(4)氯气有毒需要用氢氧化钠溶液吸收,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;
(5)酒精灯需要先点燃B处生成氯气充满装置后再点燃F处酒精灯,防止铜和空气中的氧气反应;
(6)依据化学方程式计算得到,注意被氧化的氯化氢和生成氯气的定量关系,氯气和碘单质的计算定量关系.
解答 解:(1)实验室是利用二氧化锰和浓盐酸加热反应生成氯气,A中是浓盐酸,B中是二氧化锰固体,反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:浓盐酸;二氧化锰;MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)生成的氯气中含有氯化氢,用饱和食盐水除去氯气中的氯化氢,装置D中为浓硫酸除去氯气中的水蒸气得到干燥纯净的氯气,
故答案为:饱和食盐水;浓硫酸;
(3)E中干燥的氯气遇到干燥有色布条不褪色,说明氯气无漂白作用,F装置是铜加热和氯气反应生成氯化铜的反应,生成的氯化铜形成棕色烟,反应的化学方程式为:Cu+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$CuCl2,
故答案为:干燥的红色布条不褪色;产生大量棕黄色烟;Cu+Cl2=CuCl2;
(4)氯气有毒,不能排放到空气中,需要用氢氧化钠溶液吸收,H中试剂为氢氧化钠溶液,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:氢氧化钠溶液;Cl2+2OH-=Cl-+ClO-+H2O;
(5)酒精灯需要先点燃B处生成氯气充满装置F后,再点燃F处酒精灯,防止铜和空气中的氧气反应
故答案为:先点燃B处酒精灯,待黄绿色气体充满F后,再点燃F处酒精灯;
(6)若A中有14.6g HCl被氧化,n(HCl)=$\frac{14.6g}{36.5g/mol}$=0.4mol,
MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
反应中被氧化2molHCl生成1molCl2,
0.4molHCl备氧化生成0.2molCl2,标准状况下气体体积=0.2mol×22.4L/mol=4.48L,
故答案为:4.48;
点评 本题考查了实验室制备氯气的装置分析和除杂试剂选择,氯气性质验证的反应现象判断,注意氯气是有毒气体,不能排放到空气中,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | ③④ | B. | ①③⑤ | C. | 仅有⑤ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
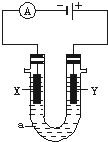 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷、丙炔 | B. | 甲醛、果糖 | C. | 乙醇、乙二醇 | D. | 甲苯、甘油 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com