
【题目】100mL 0.1mol/L盐酸与50mL 0.2mol/L 氨水混合,在所得溶液中( )
A. c(Cl-)>c(NH4+)> c(OH-)> c(H+) B. c(Cl-)=c(NH4+)> c(OH-)= c(H+)
C. c(H+)+c(Cl-)=c(NH4+)+ c(OH-)+2c(NH3.H2O) D. c(H+)+ c(NH4+)=c(Cl-)
【答案】C
【解析】A、盐酸的物质的量和氨水的物质的量相等,所以混合后生成氯化铵,氯化铵是强酸弱碱盐能水解,NH4++H2O![]() NH3·H2O+H+,溶液显酸性,则c(Cl-)>c(NH4+)> c(H+)> c(OH-),故A错误;B、盐酸的物质的量和氨水的物质的量相等,所以混合后生成氯化铵,氯化铵是强酸弱碱盐能水解,NH4++H2O
NH3·H2O+H+,溶液显酸性,则c(Cl-)>c(NH4+)> c(H+)> c(OH-),故A错误;B、盐酸的物质的量和氨水的物质的量相等,所以混合后生成氯化铵,氯化铵是强酸弱碱盐能水解,NH4++H2O![]() NH3·H2O+H+,则c(Cl-)>c(NH4+),故B错误;C、盐酸的物质的量和氨水的物质的量相等,所以混合后生成氯化铵,氯化铵是强酸弱碱盐能水解,NH4++H2O
NH3·H2O+H+,则c(Cl-)>c(NH4+),故B错误;C、盐酸的物质的量和氨水的物质的量相等,所以混合后生成氯化铵,氯化铵是强酸弱碱盐能水解,NH4++H2O![]() NH3·H2O+H+,根据电荷守恒,c(H+)+c(NH4+)= c(OH-)+c(Cl-),根据物料守恒,c(Cl-)= c(NH4+)+c(NH3·H2O),变形为2c(Cl-)=2 c(NH4+)+2c(NH3·H2O),则c(H+)+c(Cl-)=c(NH4+)+ c(OH-)+2c(NH3·H2O),故C正确;D、盐酸的物质的量和氨水的物质的量相等,所以混合后生成氯化铵,氯化铵是强酸弱碱盐能水解,NH4++H2O
NH3·H2O+H+,根据电荷守恒,c(H+)+c(NH4+)= c(OH-)+c(Cl-),根据物料守恒,c(Cl-)= c(NH4+)+c(NH3·H2O),变形为2c(Cl-)=2 c(NH4+)+2c(NH3·H2O),则c(H+)+c(Cl-)=c(NH4+)+ c(OH-)+2c(NH3·H2O),故C正确;D、盐酸的物质的量和氨水的物质的量相等,所以混合后生成氯化铵,氯化铵是强酸弱碱盐能水解,NH4++H2O![]() NH3·H2O+H+,根据电荷守恒,c(H+)+c(NH4+)= c(OH-)+c(Cl-),则c(H+)+ c(NH4+)>c(Cl-),故D错误;故选C。
NH3·H2O+H+,根据电荷守恒,c(H+)+c(NH4+)= c(OH-)+c(Cl-),则c(H+)+ c(NH4+)>c(Cl-),故D错误;故选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列反应中,属于氧化还原反应的是( )
A.2NaHCO3 ![]() ?Na2CO3+CO2↑+H2O
?Na2CO3+CO2↑+H2O
B.H2SO4+CuO═CuSO4+H2O
C.2 H2S+SO2═3S↓+2H2O
D.CO2+Ca(OH)2═CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2在常温下是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用图1所示装置模拟工业制取并收集ClO2。
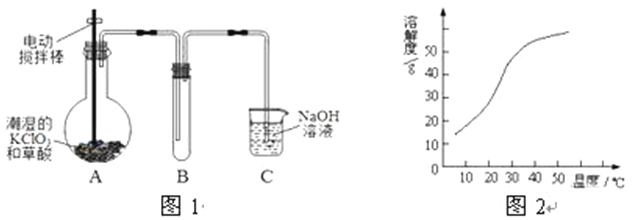
(1) A 装胃电动搅抖柞的作用是___________
(2)B装置必须放在冰水浴中,其原因是___________
(3)反应后在装置C中可得NaClO2溶液。已知I.NaClO2饱和溶液在温度低了38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2, 温度高于60℃时NaClO2分解生成NaClO3和NaCl;
Ⅱ.NaClO2的溶解度曲线如图2所示,请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:
①减压,55℃蒸发结晶;②__________;③用38℃~60℃热水洗涤;④_____;得到成品。
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100.00 mL试样;量取V1mL试样加入到锥形瓶中;
步骤2:用稀硫酸调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入指示剂,用cmol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL(已知2 Na2S2O3+ I2=Na2S4O6+ 2NaI)。
①配制100 mLcmol·L-1Na2S2O3标准溶液时,用到的玻璃仪器除烧杯、量筒、玻璃棒外还有:____________。
②原ClO2溶液的浓度为_________g/L(用含字母代数式表示)。
③若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果____________。(填“偏高”、“偏低”或“不变” )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 写出镍原子的电子排布式_____________。
(2) 丙酮(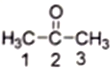 )分子中2号碳原子的杂化方式为__________;与CS2互为等电子体的阴离子是__________(写一种)。
)分子中2号碳原子的杂化方式为__________;与CS2互为等电子体的阴离子是__________(写一种)。
(3)含0.1mol[Cr(H2O)Cl]Cl2·H2O的水溶液与足量硝酸银溶液反应生成_______molAgCl沉淀。H2O分子的键角比H2S分子的键角大,原因是_______ 。
(4) 由铜与氯形成的一种化合物的晶胞结构如图所示(黑点代表铜原子)。

①该晶体的化学式为_______。
②将晶胞内的4个黑点相互连接所形成的立体构型是_______。
③晶体中与一个氯原子距离最近的氯原子有_______个。
④已知该晶体的密度为ρg.cm-3,阿伏加德罗常数的值为NA,则该晶体中铜原子和氯原子之间的最短距离为_______pm(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在制玻璃的原料中,再加入下列物质后,可制得各种不同用途的玻璃:
a.氧化亚铜(Cu2O) b.氧化钴(Co2O3)
c.氧化铅(PbO) d.硼砂(Na2B4O7·10H2O)
①制造化学仪器的玻璃需加入的物质是。
②制造光学仪器的玻璃需加入的物质是。
③制造蓝色玻璃需加入的物质是。
④制造红色玻璃需加入的物质是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+浓度为0.4 mol/L,SO42-的浓度为0.7 mol/L,则该溶液中K+的浓度为( )
A. 0.1 mol/L B. 0.15 mol/L C. 0.2 mol/L D. 0.25 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂方案错误的是
选项 | 被提纯的物质 | 杂质 | 除杂试剂 |
A | FeCl3(aq) | Fe2+ | 新制氯水 |
B | FeCl2(aq) | Fe3+ | Cu粉 |
C | NaHCO3(aq) | Na2CO3 | CO2气体 |
D | Mg粉 | Al粉 | NaOH(aq)、过滤 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com