
分析 ①化合价升高被氧化的为还原剂,化合价降低被还原的为氧化剂,根据反应物及化合价的变化判断;
②根据双键能发生加成反应分析性质,根据Br-C-C-Br和Br-C=C-Br两种不同的位置分析结构;苯分子中含有一种特殊的化学键,键长介于C-C和C=C之间,不存在单纯的单、双键.
解答 解:①由题意知,被检测的物质是乙醇,反应2CrO3 (红色)+3C2H5OH+3H2SO4=Cr2(SO4)3(绿色)+3CH3CHO+6H2O中,元素的化合价变化如下:CrO3→Cr2(SO4)3,Cr元素由+6价→+3价,得电子化合价降低,CrO3是氧化剂;C2H5OH→CH3CHO,C元素由-2价→-1价,失电子化合价升高,乙醇是还原剂,
故答案为:C2H5OH;CrO3;C2H5OH;
②a.若苯分子中含有C=C键,则能发生加成反应而使溴的四氯化碳溶液褪色,但苯不能使溴的四氯化碳溶液褪色,故a选;
b.苯能与H2发生加成反应,能够用苯分子中含有碳碳双键解释,故b不选;
c.苯为单、双键交替的正六边形平面结构,可以解释苯没有同分异构体,故c不选;
d.如果是单双建交替的正六边形平面结构,则邻二溴苯应有Br-C-C-Br和Br-C=C-Br两种不同的结构,但事实是邻二溴苯只有一种,这一点也不能解释,故d选;
苯分子中含有一种特殊的化学键,键长介于C-C和C=C之间,不存在单纯的单、双键,是介于碳碳单键和碳碳双键之间的特殊的键,
故答案为:ad;介于单键和双键之间的特殊的键.
点评 本题考查氧化还原反应、苯的组成及结构,题目难度不大,明确氧化还原反应的实质为解答关键,注意掌握常见有机物组成、结构与性质,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 硅酸钠属于盐,不属于碱,所以硅酸钠可以保存在磨口玻璃塞试剂瓶中 | |
| B. | 氢氟酸可用带橡胶塞的玻璃试剂瓶保存 | |
| C. | 普通玻璃、石英玻璃、水泥等均属于硅酸盐材料 | |
| D. | 祖母绿的主要成分为Be3Al2Si6O18,用氧化物形式表示为3BeO•Al2O3•6SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同条件下的沸点:丙三醇>乙二醇>乙醇>乙烷>甲烷 | |
| B. | 将浸透了石蜡油的石棉放在大试管底部,大试管中加入碎瓷片,加强热,将产生的气体持续通入溴的四氯化碳溶液中,红棕色逐渐变浅,最终褪色 | |
| C. | -C3H7和-C2H5O各取代苯分子中的一个氢原子形成的二元取代物的同分异构体有24种 | |
| D. | 薄荷醇 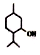 中至少有12个原子共平面 中至少有12个原子共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | W、X是金属元素 | |
| B. | 原子半径:R<Y<Z | |
| C. | 简单气态氢化物的热稳定性:R>Z | |
| D. | X、Y、Z的最高价氧化物对应的水化物能相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3mol/(L•s) | B. | 0.3mol/(L•s) | C. | 0.6mol/(L•s) | D. | 0.1mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氧化还原反应中,一定是有一种元素被氧化,另一种元素被还原 | |
| B. | 没有单质参加或生成的反应一定不是氧化还原反应 | |
| C. | 失电子难的原子,获得电子的能力一定强 | |
| D. | 元素由化合态变成游离态时,它可能被氧化,也可能被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 700℃ | 900℃ | |
| K3 | 1.47 | 2.15 |
| K4 | 2.38 | 1.67 |
| T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| 543 | Cat.1 | 12.3 | 42.3 |
| 543 | Cat.2 | 10.9 | 72.7 |
| 553 | Cat.1 | 15.3 | 39.1 |
| 553 | Cat.2 | 12.0 | 71.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com