
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3能氧化氮氧化物,可用于汽车尾气净化 | |
| B. | Mg、Fe等金属在一定条件下与水反应都生成H2和对应的氢氧化物 | |
| C. | Fe在氧气中的燃烧产物可用于制红色涂料 | |
| D. | Mg(OH)2分解吸热且生成高熔点固体,可作阻燃剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 |
| A | Fe2+、NO${\;}_{3}^{-}$、NH${\;}_{4}^{+}$ | NaHSO4溶液 | 3Fe${\;}^{2{+}_{\;}^{\;}}$+NO${\;}_{3}^{-}$+4H+═3Fe3++NO↑+2H2O |
| B | Ca2+、HCO${\;}_{3}^{-}$、Cl- | 少量NaOH溶液 | Ca2++2HCO${\;}_{3}^{-}$+2OH-═2H2O+CaCO3↓+CO${\;}_{3}^{2-}$ |
| C | K+、AlO${\;}_{2}^{-}$、HCO${\;}_{3}^{-}$ | 通入少量CO2 | 2AlO${\;}_{2}^{-}$+3H2O+CO2═2Al(OH)3↓+CO${\;}_{3}^{2-}$ |
| D | NH${\;}_{4}^{+}$、Al3+、SO${\;}_{4}^{2-}$ | 少量Ba(OH)2溶液 | 2NH${\;}_{4}^{+}$+SO${\;}_{4}^{2-}$+Ba2++2OH-═BaSO4↓+2NH3.H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
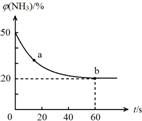 合理应用和处理氮的化合物,在生产生活中有重要意义.
合理应用和处理氮的化合物,在生产生活中有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加A的物质的量 | B. | 升高体系温度 | ||
| C. | 增加体系压强 | D. | 减少C的物质的量浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl属于共价化合物,溶于水能电离出H+和Cl- | |
| B. | NaOH是离子化合物,该物质中只含离子键 | |
| C. | HI气体受热分解的过程中,只需克服分子间作用力 | |
| D. | 石英和干冰均为原子晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com