
【题目】根据物质的组成和分类,MgCl2属于
A. 氧化物B. 酸C. 碱D. 盐
科目:高中化学 来源: 题型:
【题目】一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示。请回答:

(1)O点为什么不导电_______。
(2)a、b、c三点c(H+)由大到小的顺序是_____。
(3)a、b、c三点中醋酸的电离程度最大的点是_____点。
(4)若使c点溶液中的c(CH3COO-)提高,可采取的措施是____(填标号)。
A.加热 B.加很稀的NaOH溶液 C.加固体KOH D.加水 E.加固体CH3COONa F.加锌粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置正确且能达到对应实验目的的是
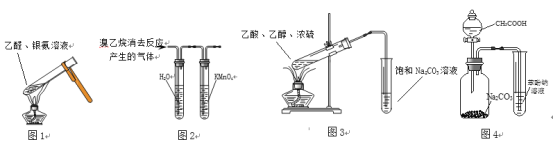
A. 用图1装置进行银镜反应
B. 用图2装置检验溴乙烷消去后的产物是否含乙烯
C. 用图3装置制备乙酸乙酯
D. 用图4装置比较乙酸、碳酸、苯酚的酸性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】牛通过吃草从草中获得化合物和元素。那么,牛和草体内的各种化学元素( )
A.种类差异很大,含量大体相同B.种类和含量差异都很大
C.种类和含量都是大体相同的D.种类大体相同,含量差异很大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一种锂离子二次电池,其工作原理如图。放电时生 成的Li2CO3固体和碳储存于碳纳米管中。下列说法错误的是
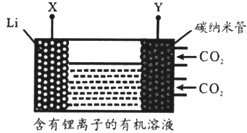
A. 该电池中的有机溶剂不能含活性较大的氢
B. 充电时,Y为阳极,Li+向X电极移动
C. 放电时,负极反应为2Li+CO32-—2e-===Li2CO3
D. 放电时,电池总反应为3CO2+4Li===2Li2CO3+C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL 18mol/L的硫酸中加入足量的铜片并加热,被还原的硫酸的物质的量
A. 小于0.45mo1B. 等于0.45molC. 在0.45mol和0.9mol之间D. 大于0.9mo1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:

已知:①RCHO+CH3CHO ![]() RCH=CHCHO+H2O;②
RCH=CHCHO+H2O;②![]() 。
。
回答下列问题:
(1)C的结构简式为_______________________。
(2)F中官能团的名称为___________________。
(3)B与新制Cu(OH)2悬浊液反应的化学方程式为________________。
(4)从转化流程图可见,由D到E分两步进行,其中第一步反应的类型为__________。
(5)化合物G的二氯代物有__________种同分异构体。
(6)芳香化合物X是D的同分异构体,X能发生银镜反应,其核磁共振氢谱显示有3种化学环境的氢,峰面积之比为6∶1∶1,符合条件的X的结构共有多种,任写出2种符合要求的X的结构简式________、___________。
(7)写出用甲醛和乙醛为原料制备化合物CH2=CHCOOCH3的合成路线(其他试剂任选)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合所学内容,回答下列问题:
Ⅰ.某同学进行影响草酸与酸性高锰酸钾溶液反应速率因素的研究。草酸与酸性高锰酸钾的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。室温下,两支试管分别编号①和②,实验数据如下:
实验序号 | ① | ② |
加入试剂 | 4 mL 0.01mol/L酸性 KMnO4溶液 2 mL 0.1mol/L H2C2O4溶液 | 4 mL 0.01mol/L酸性 KMnO4溶液 2 mL 0.1mol/L H2C2O4溶液 一粒黄豆粒大的MnSO4固体 |
褪色时间/s | 116 | 6 |
试管①中KMnO4溶液褪色的速率开始十分缓慢,一段时间后突然加快。
请回答:
(1)该实验结论是___________________________________________________________。
(2)实验②选用MnSO4固体而不是MnCl2固体的原因是____________________________。
(3)该同学为使实验更加严密,在试管③中做了如下实验,请预测褪色时间约为_____。
实验序号 | ③ |
加入试剂 | 4 mL 0.01mol/L酸性 KMnO4溶液 2 mL 0.1mol/L H2C2O4溶液 一粒黄豆粒大的Na2SO4固体 |
褪色时间/s |
Ⅱ.滴定法是一种重要的定量分析方法,应用范围很广。某地市场上销售的一种食用精制盐包装袋上有如下部分说明:
产品等级 | 一级 |
配料 | 食盐、碘酸钾(KIO3)、抗结剂 |
碘含量(以I计) | 20~50 mg·kg-1 |
已知:IO3-+5I-+6H+ = 3I2+3H2O,I2+2S2O32- = 2I-+S4O62-某学生拟测定食用精制盐的碘含量,其步骤为
a.准确称取W g食盐,加适量蒸馏水使其完全溶解
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c.加入指示剂,逐滴加入物质的量浓度为2.0×10/span>-3 mol·L-1的Na2S2O3溶液10.0 mL,恰好反应完全
(4)c中加入的指示剂可选用_________,恰好完全反应时的现象是_______________。
(5)若操作b在空气中振荡时间过长,则最终测定的测定食用精制盐中的的碘含量会__________(填“偏高”、“偏低”或“没有影响”)。
(6)根据以上实验和包装说明,算得所测食用精制盐的碘含量是(以含W的代数式表示)________mg·kg-1(计算结果保留整数即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com