
【题目】现有A、B、C、D 4种元素,前3种元素的离子都和氖原子具有相同的核外电子排布。A元素没有正化合价;B的氢化物分子式为H2B。0.2 mol的C单质能从酸中置换出2.24 L H2(标准状况)。D的原子核中没有中子。
(1)根据以上条件,判断A、B、C、D的元素名称:
A________,B________,C________,D________。
(2)用电子式表示C与A、C与B、B与D相互结合成的化合物,指出其化合物的类型及化学键类型:
①C+A2:电子式____________,化合物类型__________,化学键类型____________;
②C+B2:电子式____________,化合物类型__________,化学键类型____________;
③B+D2:电子式____________,化合物类型__________,化学键类型____________;
【答案】氟 氧 钠 氢 ![]() 离子化合物 离子键
离子化合物 离子键 ![]() (或
(或![]() ) 离子化合物 离子键(或离子键、非极性共价键)
) 离子化合物 离子键(或离子键、非极性共价键) ![]() (或
(或![]() ) 共价化合物 极性共价键(或极性共价键、非极性共价键)
) 共价化合物 极性共价键(或极性共价键、非极性共价键)
【解析】
A、B、C三种元素的离子结构都和氖原子具有相同的核外电子排布,A没有正价态的化合物,B的氢化物化学式为H2B,则A为F、B为O;0.2molC单质能从酸中置换产生2.24LH2(标准状况),C为金属,氢气是0.1mol,则其化合价为+1价,C为Na,D的原子核内没有中子,则D元素为氢;据此解答。
(1)根据上述分析可知,四种元素分别为:氟、氧、钠、氢;
(2)①C元素为钠,A元素为氟,二者形成的化合物为氟化钠,电子式为:![]() ;在氟化钠中含有离子键,其属于离子化合物
;在氟化钠中含有离子键,其属于离子化合物
②C元素为钠,B元素为氧,二者形成的化合物为氧化钠,钠失电子,氧得电子,形成离子化合物,电子式为:![]() ,该物质中含有离子键;钠在氧气中燃烧能生成过氧化钠,电子式为:
,该物质中含有离子键;钠在氧气中燃烧能生成过氧化钠,电子式为:![]() ,该物质中含有离子键和非极性共价键;
,该物质中含有离子键和非极性共价键;
③B元素为氧,D元素为氢,二者形成的化合物为水,水的电子式为:![]() ,氢和氧形成共用电子对,分子中只含有极性共价键,为共价化合物;氢与氧还能形成过氧化氢,过氧化氢的电子式为:
,氢和氧形成共用电子对,分子中只含有极性共价键,为共价化合物;氢与氧还能形成过氧化氢,过氧化氢的电子式为:![]() ,其中含有极性共价键和非极性共价键,为共价化合物。
,其中含有极性共价键和非极性共价键,为共价化合物。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】对牙膏的探究要用到许多化学知识。
(1)下表列出了三种牙膏中的摩擦剂,请在表中填写三种摩擦剂所属的物质类别:____、____、_____。

(2)根据你的推测,牙膏摩擦剂在水中的溶解性是__(填“易溶”或“难溶”)。
(3)Y牙膏中的摩擦剂——碳酸钙可以用石灰石来制备,某学生设计了一种实验室制备碳酸钙的实验方案,其流程如图所示:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
请写出上述方案中有关反应的化学方程式:
①__;
②__;
③__。
(4)请你仍用石灰石作原料(其他试剂自选),设计实验室制备碳酸钙的另一种实验方案,依照(3)所示的方式,将你的实验方案用流程图表示出来:
![]() →_。
→_。
(5)检验牙膏中是否含有碳酸钙的实验方法是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某镍冶炼车间排放的漂洗废水中含有一定浓度的![]() 和
和![]() ,图甲是双膜三室电沉积法回收废水中的
,图甲是双膜三室电沉积法回收废水中的![]() 的示意图,图乙描述的是实验中阴极液pH值与镍回收率之间的关系。下列说法不正确的是()
的示意图,图乙描述的是实验中阴极液pH值与镍回收率之间的关系。下列说法不正确的是()![]() 镍的相对原子质量约为59)
镍的相对原子质量约为59)
图甲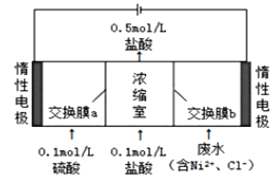 图乙
图乙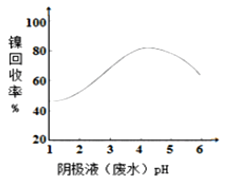
A.交换膜a为阳离子交换膜
B.浓缩室得到![]() 的盐酸时,阴极回收得到
的盐酸时,阴极回收得到![]() 镍
镍
C.阴极液![]() 时,镍的回收率低主要是有较多的
时,镍的回收率低主要是有较多的![]() 生成
生成
D.阳极反应式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中,A为一种中学化学中常见的单质,B、C、D、E是含有A元素的常见化合物。它们的焰色实验均为黄色。

(1)写出下列物质的化学式:B___。
(2)以上6个反应中属于氧化还原反应的有___(填写编号)。
(3)写出A →C反应的离子方程式___。
(4)写出B→C反应的离子方程式:___;E→D的化学方程式:___。
(5)加热5.00gD和E的固体混合物,使E完全分解,固体混合物的质量减少了0.31g,则原混合物中D的质量分数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萘、四氢萘、十氢萘用途广泛,其转化关系为: ,该过程中能量变化如图所示,下列说法不正确的是:
,该过程中能量变化如图所示,下列说法不正确的是:

A.萘分子(![]() )的一氯代物有2种
)的一氯代物有2种
B.实线表示无催化剂的反应过程,虚线表示有催化剂的反应过程
C.E1、E2表示活化能,a的大小由E1决定,b的大小由E2决定
D.物质的稳定性:十氢萘>四氢萘>萘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。为减少污染并变废为宝,工厂计划从该废水中回收FeSO4和金属Cu。根据流程图,下列说法不正确的是

A.①②操作均为过滤,但D、E溶液成分不完全相同
B.C可以为稀硫酸,也可以是稀盐酸
C.操作③采用冷却结晶,说明硫酸亚铁晶体的溶解度随温度变化有一定变化
D.A为足量铁粉,其反应的离子方程式为:Fe+Cu2+=Fe2++Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组欲测定酸性条件下KClO3溶液与NaHSO3溶液反应的化学反应速率,所用的试剂为10mL 0.1mol/L KClO3溶液和10mL 0.3mol/L NaHSO3溶液,所得c(Cl-)随时间变化的曲线如图所示:

(1)根据实验数据可知,该反应在0~4min的平均反应速率v(Cl-)=______mol/(L·min)。
(2)反应过程中,该反应的化学反应速率变化趋势为先增大后减小。
i.探究化学反应速率增大的影响因素:
已知:ClO3-+3HSO3-=Cl-+3SO42-+3H+
方案 | 假设 | 具体实验操作 |
Ⅰ | 该反应放热,使溶液温度升高,反应速率加快 | 向烧杯中依次加入10mL 0.1mol/L KClO3溶液和10mL 0.3mol/L NaHSO3溶液,______。 |
Ⅱ | 反应产物Cl-对反应有催化作用 | 取10mL 0.1mol/L KClO3溶液于烧杯中,先加入_____固体(填化学式),再加入10mL 0.3mol/L NaHSO3溶液。 |
Ⅲ | 反应中溶液酸性增强,加快了化 学反应速率 | 分别向2个烧杯中加入10mL 0.1mol/L KClO3溶液, 烧杯①:加入1mL水烧杯②:加入1mL 0.2mol/L盐酸再分别向烧杯中加入10mL 0.3mol/L NaHSO3溶液。 |
(问题与思考)
①方案Ⅲ烧杯①中加入1mL水的作用是______。
②在证明方案Ⅰ假设不成立的情况下,从控制变量角度思考,方案III实验操作设计不严谨,改进措施为______。
③除方案Ⅰ、Ⅱ、Ⅲ外,请再提出一个可能使化学反应速率增大的假设_______。
ii.反应后期,化学反应速率降低的主要原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微粒有多种表示方式,下列各组不同表示方式一定代表同种微粒的是( )
A.C2H5Cl、CH3CH2ClB.OH﹣、![]()
C.![]() 、
、 D.C2H6O、CH3CH2OH
D.C2H6O、CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知MnO![]() 、NO
、NO![]() 等在酸性条件下具有强氧化性,而S2-、I-、Fe2+等具有较强的还原性。下列水溶液中的各组离子因为发生氧化还原反应而不能大量共存的是( )
等在酸性条件下具有强氧化性,而S2-、I-、Fe2+等具有较强的还原性。下列水溶液中的各组离子因为发生氧化还原反应而不能大量共存的是( )
A. Na+、Ba2+、Cl-、SO42— B. MnO4-、K+、I-、H+
C. Ca2+、HCO3—、Cl-、K+ D. H+、Cl-、Na+、CO32—
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com