
| A. | 用带橡皮塞的棕色试剂瓶存放浓硝酸 | |
| B. | 容量瓶、分液漏斗使用前均需检查是否漏水 | |
| C. | 分液漏斗分液时,必须先将下层液体从下口放出,再将上层液体从上口倒出 | |
| D. | 蒸馏时,需将温度计的水银球没入液面以下且不接触烧瓶壁 | |
| E. | 氨气喷泉实验时,收集气体的烧瓶必须干燥 | |
| F. | 用玻璃棒蘸取待测液,点在润湿的pH试纸上测定其pH |
分析 A.浓硝酸能腐蚀橡胶;
B.带有旋塞和瓶塞的仪器,一般在使用前需要检查是否漏水;
C.分液时,上层液体从上口倒出,下层液体从下口倒出;
D.蒸馏时,温度计测量馏分温度;
E.利用压强差形成喷泉;
F.测定溶液的pH值时,pH试纸不能事先润湿.
解答 解:A.浓硝酸腐蚀橡胶,所以能加快橡胶老化,所以浓硝酸不能存放在带橡胶塞的棕色玻璃瓶中,故A错误;
B.带有旋塞和瓶塞的仪器,一般在使用前需要检查是否漏水,所以容量瓶和分液漏斗在使用前均需检查是否漏水,故B正确;
C.分液时,上层液体从上口倒出,下层液体从下口倒出,否则易导致引入杂质,故C正确;
D.蒸馏时,温度计测量馏分温度,所以温度计水银球应该位于蒸馏烧瓶支管口处,故D错误;
E.因为氨气极易溶于水,氨气喷泉实验时,如果收集气体的烧瓶不干燥,会导致部分氨气溶于水,而达不到形成喷泉的压强差,导致无法形成喷泉实验,所以所以氨气喷泉实验时,收集气体的烧瓶必须干燥,故E正确;
F.测定溶液的pH值时,pH试纸不能事先润湿,否则导致溶液浓度降低,测定的pH值可能改变,故F错误;
故选BCE.
点评 本题考查化学实验评价,为高频考点,涉及实验基本操作,明确实验原理及基本操作规范性是解本题关键,注意蒸馏时温度计位置,为易错点.


科目:高中化学 来源: 题型:解答题
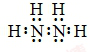 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| v(mol•L-1•s-1) | c(H2)(mol•L-1) | c(Cl2)(mol•L-1) |
| 1.0k | 1.0 | 1.0 |
| 2.0k | 2.0 | 1.0 |
| 4.0k | 2.0 | 4.0 |
| A. | m=1,n=1 | B. | m=$\frac{1}{2}$,n=$\frac{1}{2}$ | C. | m=$\frac{1}{2}$,n=1 | D. | m=1,n=$\frac{1}{2}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -5.56×104 kJ•mol-1 | B. | 5.56×104 kJ•mol-1 | ||
| C. | 5.56×104 kJ | D. | -5.56×104 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用O3替代Cl2作饮用水消毒剂更符合绿色化学的要求 | |
| B. | “光化学烟雾”、“臭氧空洞”的形成都与氮氧化合物有关 | |
| C. | 尽量使用含12C的产品,减少使用含13C或14C的产品符合“促进低碳经济”宗旨 | |
| D. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用pH计测定0.1mol/L氨水的pH | |
| B. | 用pH试纸测定0.1mol/LNH4Cl溶液的pH | |
| C. | 将氨水连接在一个带灯泡的通电电路中,观察灯泡亮度 | |
| D. | 等浓度、等体积的氨水和NaOH分别与等浓度的盐酸反应,比较消耗盐酸体积的多少 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
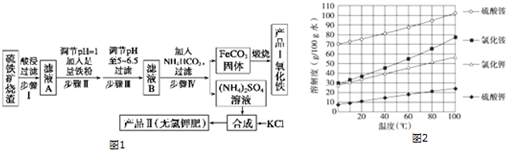
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com