
下列实验现象预测正确的是()
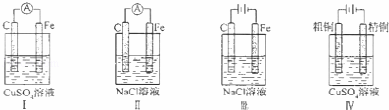
A. 实验Ⅰ:电流表A指针偏转,碳棒上有气泡冒出
B. 实验Ⅱ:电流表A指针偏转,铁极上有无色气体产生
C. 实验Ⅲ:碳棒上有无色气体产生,铁极上有黄绿色气体产生
D. 实验IV:粗铜溶解,精铜上有红色固体析出
考点: 原电池和电解池的工作原理.
分析: A.实验I:该装置符合原电池构成条件,能形成原电池,所以有电流产生,铁易失电子而作负极,碳作正极,正极上得电子发生还原反应;
B.实验II:该电池符合原电池构成条件,能形成原电池,所以有电流产生,铁发生吸氧腐蚀;
C.实验III:该装置是电解池,碳作阳极,铁作阴极,阳极上氯离子放电,阴极上氢离子放电;
D.实验IV:该装置是电解池,为粗铜的精炼,精铜作阴极,阴极上铜离子得电 子发生还原反应.
子发生还原反应.
解答: 解:A.实验I:该装置符合原电池构成条件,能形成原电池,所以有电流产生,铁易失电子而作负极,碳作正极,碳棒上铜离子得电子生成铜单质,所以碳棒上有红色物质析出,没有有气泡冒出,故A错误;
B.实验II:该电池符合原电池构成条件,能形成原电池,所以有电流产生,铁易失电子生成亚铁离子而作负极,没有无色气体产生,故B错误;
C.实验III:该装置是电解池,碳作阳极,铁作阴极,碳棒上氯离子放电生成黄绿色的氯气,铁棒上氢离子放电生成无色的氢气,故C错误;
D.实验IV:该装置是电解池,精铜作阴极,阴极上铜离子得电子发生还原反应生成金属单质铜,故D正确;
故选D.
点评: 本题考查了原电池和电解池原理,原电池和电解池原理是电化学的重点内容,是2015届高考热点内容,会根据得失电子确定各个电极上发生的电极反应,难点是电极反应式的书写.


科目:高中化学 来源: 题型:
有A、B、C、D四种金属,当A、B组成原电池时,电子流动方向A→B;当A、D组成原电池时,A为正极;B与E构成原电池时,电极反应式为:E2﹣+2e﹣→E,B﹣2e﹣→B2+则A、B、D、E金属性由强到弱的顺序为()
A. A>B>E>D B. A>B>D>E C. D>E>A>B D. D>A>B>E
查看答案和解析>>
科目:高中化学 来源: 题型:
对相同状况下的12C18O和14N2两种气体,下列说法正确的是()
A. 若质量相等,则质子数相等
B. 若原子数相等,则中子数相等
C. 若分子数相等,则体积 相等
相等
D. 若体积相等,则密度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
1L某混合溶液中可能含有的离子如下表:
可能大量含有的阳离子 H+NH4+Al3+K+
可能大量含有的阴离子 Cl﹣Br﹣I‑ClO‑AlO2﹣
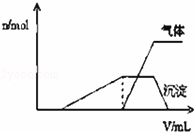
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生 沉淀和气体的物质的量(n)与加入NaOH溶液的体积(v)的关系如图所示.
①则该溶液中确定含有的离子有 ;
②不能确定是否含有的阳离子有K+,
③要确定其存在可补充做的实验是 ;
④肯定不存在的阴离子有 .
(2)经检测,该溶液中含有大量的Cl﹣、Br﹣、I﹣,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl﹣、Br﹣、I﹣的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
Cl2的体积
(标准状况) 2.8L 5.6L 11.2L
n(Cl﹣) 1.25mol 1.5mol 2mol
 n(Br﹣) 1.5mol 1.4mol 0.9mol
n(Br﹣) 1.5mol 1.4mol 0.9mol
n(I﹣) a mol 0 0
①当通入Cl2的体积为2.8L时,溶液中发生反应的离子方程式为 .
②原溶液中Cl﹣、Br﹣、I﹣的物质的量浓度之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
对下列化学反应的热现象的说法正确的是()
A. 放热反应发生时不必加热
B. 化学反应过程中一定有能量变化
C. 吸热反应需要加热后才能发生
D. 化学反应吸收或放出热量的多少与参加反应的物质的多少有关
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列热化学方程式:①H2(g)+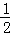 O2 (g)=H2O(l);△H=﹣285kJ•mol﹣1
O2 (g)=H2O(l);△H=﹣285kJ•mol﹣1
②H2(g)+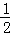 O2 (g)=H2O(g);△H=﹣241.8kJ•mol﹣1
O2 (g)=H2O(g);△H=﹣241.8kJ•mol﹣1
③C(s)+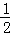 O2 (g)=CO(g);△H=﹣110.5kJ•mol﹣1
O2 (g)=CO(g);△H=﹣110.5kJ•mol﹣1
④C(s)+O2 (g)=CO2(g);△H=﹣393.5kJ•mol﹣1
回答下列问题:
(1)H2的燃烧热△H为 ;C的燃烧热△H为 .
(2)燃烧1g H2生成液态水,放出的热量为 KJ.
(3)写出CO燃烧的热化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
4A(s)+3B(g)═2C(g)+D(g),经2min后B的浓度减少0.6mol•L﹣1.对此反应速率的表示正确的是()
A. 用A表示的反应速率是0.4mol•L﹣1•min﹣1
B. 分别用B、C、D表示反应速率,其比值是3:2:1
C. 在2min末的反应速率,用B表示是0.3mol•L﹣1•min﹣1
D. 在2min内的反应速率,用C表示是0.3mol•L﹣1•min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
对处于化学平衡的体系,由化学平衡与化学反应速率的关系可知()
A. 化学反应速率变化时,化学平衡一定发生移动
B. 化学平衡发生移动时,化学反应速率一定变化
C. 正反应进行的程度大,正反应速率一定大
D. 改变压强,化学反应速率一定改变,平衡一定移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com