
【题目】工业上用铝土矿(主要成分为![]() )提取氧化铝作冶炼铝的原料,提取的操作过程如下:
)提取氧化铝作冶炼铝的原料,提取的操作过程如下:

(1)反应1结束后的操作名称为_______。
(2)滤渣的主要成分是___________________。
(3)反应2中通入的过量气体为________
a. 二氧化碳 b.氨气 c.氮气
(4)写出B煅烧生成Al2O3的化学反应方程式:_______________________。
【答案】过滤 氧化铁 a 2Al(OH)3 ![]() Al2O3 + 3H2O
Al2O3 + 3H2O
【解析】
铝土矿加入氢氧化钠溶液,氧化铝、二氧化硅与氢氧化钠反应,氧化铁不与氢氧化钠反应,过滤,得到滤渣氧化铁,滤液主要是偏铝酸钠和硅酸钠,向滤液中加入氧化钙,得到硅酸钙沉淀,过滤,向滤液中通入二氧化碳得到碳酸氢钙和氢氧化铝,过滤,B为氢氧化铝,再煅烧得到氧化铝。
⑴根据操作后得到滤液和滤渣说明反应1结束后的操作名称为过滤;故答案为:过滤。
⑵氧化铁不与氢氧化钠反应,因此滤渣的主要成分是氧化铁;故答案为:氧化铁。
⑶滤液II是偏铝酸根,因此通入过量二氧化碳与偏铝酸根生成氢氧化铝沉淀;故答案为:a。
⑷B为氢氧化铝,煅烧生成Al2O3的化学反应方程式:2Al(OH)3 ![]() Al2O3 + 3H2O;故答案为:2Al(OH)3
Al2O3 + 3H2O;故答案为:2Al(OH)3 ![]() Al2O3 + 3H2O。
Al2O3 + 3H2O。


科目:高中化学 来源: 题型:
【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等;②沉淀I中只含有两种沉淀;③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中Co2O3发生反应的离子反应方程式为_________________。
(2)NaClO3在浸出液中发生的离子反应方程式为______________。
(3)加入Na2CO3调PH至5.2,目的是________;萃取剂层含锰元素,则沉淀II的主要成分为_____。
(4)操作I包括:将水层加入浓盐酸调整PH为2-3,______、_____、过滤、洗涤、减压烘干等过程。
(5)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥,测沉淀质量。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是_____(回答一条原因即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业用强氧化剂PbO2来制备KClO4的工业流程如下:

根据流程推测,下列判断不正确的是( )
A.“酸化”的试剂是稀硝酸或浓盐酸
B.“滤渣”主要成分是PbO2粉末,可循环使用
C.NaClO3与PbO2反应的离子方程式为![]()
D.在KNO3、KClO4、NaClO4、NaNO3中,常温下溶解度小的是KClO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯胺(NCl3)是一种饮用水二级消毒剂,可由以下反应制备:
Ⅰ.![]()
![]()
回答下列问题:
(1)已知:Ⅱ.![]()
![]()
Ⅲ.![]()
![]()
则![]() =________(用含
=________(用含![]() 和
和![]() 的代数式表示)。
的代数式表示)。
(2)向容积均为2L的甲乙两个恒温密闭容器中分别加入4mol NH3和4mol Cl2,发生反应Ⅰ,测得两容器中n(Cl2)随反应时间的变化情况如下表所示:
时间/min | 0 | 40 | 80 | 120 | 160 |
容器甲(T1) | 4.0 | 3.0 | 2.2 | 1.6 | 1.6 |
容器乙(T2) | 4.0 | 2.9 | 2.0 | 2.0 | 2.0 |
①0~80min内,容器甲中v(NH3)=________________。
②反应Ⅰ的![]() ________0(填“>”或“<”),其原因为________________________。
________0(填“>”或“<”),其原因为________________________。
③关于容器乙,下列说法正确的是________
A.容器内![]() ,说明反应达到平衡状态
,说明反应达到平衡状态
B.反应进行到70min时,v正一定大于v逆
C.容器内气体平均相对分子质量在增大,说明平衡在正向移动
D.达平衡后,加入一定量NCl3(l),平衡逆向移动
E.达平衡后,按原投料比再充入一定量反应物,平衡后NH3的转化率增大
④温度为T1时HCl(g)的平衡体积分数=________,该温度下,若改为初始体积为2L的恒压容器,平衡时容器中n(Cl2)________(填“>”、“=”或“<”)1.6mol。
⑤温度为T2时,该反应的平衡常数K=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修5:有机化学基础]
利用化学方法合成味精的路线如下图所示:
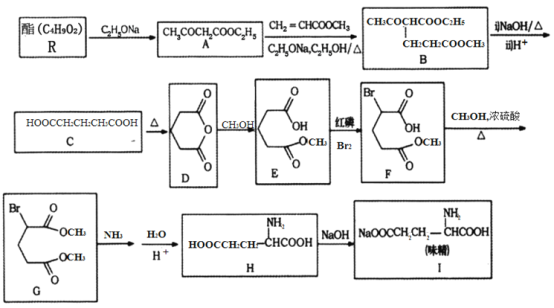
请回答以下问题:
(1)R的结构简式为________;由A生成B的反应类型是________。
(2)F中含氧官能团的名称为________;化合物H的化学名称为________________。
(3)写出由C生成D的化学方程式________________。
(4)写出一种符合下列要求的A的同分异构体的结构简式________。
①结构中含有六元环,光谱测定显示,分子结构中不存在甲基;
②能在NaOH溶液中发生水解反应;
③1mol该物质与足量金属Na反应能够生成0.5mol H2
(5)参照上述合成路线,写出以苯丙酸(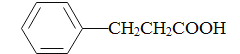 )和甲醇(其它无机试剂任选),设计合成苯丙氨酸(
)和甲醇(其它无机试剂任选),设计合成苯丙氨酸(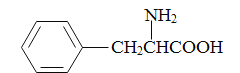 )的路线。_______________________________________________________________________
)的路线。_______________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将一定量的N2(g)和H2(g)放入2L的密闭容器中,在500℃、2×107Pa下发生如下反应:N2(g)+3H2(g) ![]() 2NH3(g)
2NH3(g)
①在反应体系中加入催化剂,该反应的反应热_____(填“增大”、“减小”或“不变”)。
②5分钟后达到平衡,测得N2为0.2 mol,H2为0.6 mol,NH3为0.2 mol。氮气的平均反应速率υ(N2)=___________,H2的转化率为_____________(保留小数点后一位)。
③欲提高②容器中H2的转化率,下列措施可行的是____________。
a.把气体的体积压缩至1L b.向容器中再充入惰性气体
c.改变反应的催化剂 d.液化生成物分离出氨
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生下列反应:2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g) ΔH=akJ/mol,进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
4NH3(g)+3O2(g) ΔH=akJ/mol,进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
T/K | 303 | 313 | 323 |
NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
此合成反应的a_________0。(填“大于”、“小于”或“等于”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中字母分别表示一种元素。请回答下列问题:
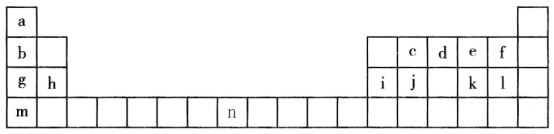
(1)a的三种核素分别为______、______、______。(用汉字表示)
(2)j是一种良好的____________材料,写出元素j的氧化物的一种用途____________。
(3)a、d、f、g四种元素的原子半径由小到大的顺序为________(用元素名称表示)。
(4)c、d、j、l四种元素最高价氧化物对应的水化物的酸性由强到弱的顺序为______(用化学式表示)。
(5)上述元素形成的氢化物中最稳定的是_____,溶于水显碱性的是_____。
(6)e、k 两种元素得电子能力强的是_____ (用元素符号表示)
(7)元素g、e 形成的原子个数1:1的化合物的化学式为_____,阴阳离子个数比为为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是地球上组成生命的最基本的元素之一,是形成单质及其化合物种类最多的元素。
(1)碳原子核外有________种不同空间运动状态的电子。
(2)碳元素能形成多种无机物。
①CO![]() 的立体构型是______________与其互为等电子体的阴离子_________________。
的立体构型是______________与其互为等电子体的阴离子_________________。
②MgCO3分解温度比CaCO3低的原因是_________________________。
(3)碳能与氢、氮、氧三种元素构成化合物CO(NH2)2,该分子中各元素的电负性由大到小的顺序为________,其中C原子的杂化方式为_______,该物质易溶于水的主要原因是________________。
(4)CO是碳元素的常见氧化物,与N2互为等电子体,则CO的结构式为________
(5)图为碳的另一种同素异形体金刚石的晶胞,其中原子坐标参数为A(0,0,0),B![]() ,C
,C![]() ;则D原子的坐标参数为________。
;则D原子的坐标参数为________。
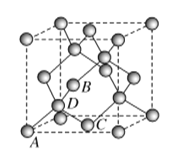
(6)立方氮化硼晶体的结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5 pm。立方氮化硼的密度是________ g·cm-3(列出计算式即可,阿伏加德罗常数的值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合物F的合成路线图如下:

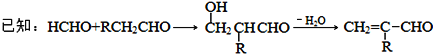
请据此回答:
(1)A中含氧官能团名称是_______,C的系统命名为_________。
(2)检验B中所含官能团所用的试剂有______;E→F的反应类型是___________。
(3)C生成D的反应化学方程式为_____________________________,如果C与NaOH的醇溶液反应,则生成的有机物的结构简式为________(同一个碳原子上连两个碳碳双键的除外)。
(4)G物质与![]() 互为同系物,且G物质的相对分子质量比
互为同系物,且G物质的相对分子质量比![]() 大14的,则符合下列条件的G的同分异构体有____种。
大14的,则符合下列条件的G的同分异构体有____种。
① 分子中含有苯环,且苯环上有两个取代基 ② 遇氯化铁溶液变紫色
③ 能与溴水发生加成反应
(5) 参照上述合成路线,设计一条由甲醛、乙醛和甲醇为主要原料制备 ![]() 的合成路线__________________。
的合成路线__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com