
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数Ka | 1.8×10-5 | 4.9×10-10 | Ka1=4.3×10-7; Ka2=5.6×10-11 |
分析 相同温度下,酸的强弱酸性是:CH3COOH>H2CO3>HCN>HCO3-,酸根离子水解程度大小顺序是:CO32->CNO->HCO3->CH3COO-,相同浓度的钠盐溶液中,酸根离子水解程度越大其溶液的pH越大;
CH3COO-+H2O?CH3COOH+OH-的水解平衡,得出Kb=$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$=$\frac{{K}_{w}}{K(C{H}_{3}COOH)}$,醋酸根离子的水解程度较小,则c(CH3COO-)≈0.18mol/L,据此计算出溶液中醋酸钠氢氧根离子浓度,再计算出该醋酸钠溶液的pH.
解答 解:相同温度下,酸的强弱酸性是:CH3COOH>H2CO3>HCN>HCO3-,酸根离子水解程度大小顺序是:CO32->CN->HCO3->CH3COO-,相同浓度的钠盐溶液中,酸根离子水解程度越大其溶液的pH越大,所以物质的量浓度为0.1mol•L-1的下列四种物质的溶液a.CH3COONa,b.NaCN,c.Na2CO3,d.NaHCO3的pH由大到小的顺序是c>b>d>a;
由水解反应CH3COO-+H2O?CH3COOH+OH-可知得出醋酸根离子的水解平衡常数:Kb=$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$=$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{{K}_{w}}{K(C{H}_{3}COOH)}$,醋酸根离子的水解程度较小,则c(CH3COO-)≈0.18mol/L,所以0.18mol•L-1 CH3COONa溶液中:c(OH-)=$\frac{{K}_{w}}{K(C{H}_{3}COOH)}$×c(CH3COO-)=$\frac{1×1{0}^{-14}}{1.8×1{0}^{-5}}$×0.18mol/L=1×10-5mol/L,该溶液中氢离子浓度为:$\frac{1×1{0}^{-14}}{1×1{0}^{-5}}$=1×10-9,该溶液的pH=9,
故答案为:c>b>d>a; 9.
点评 本题考查了溶液pH的计算、盐的水解原理及其影响,题目难度中等,明确盐的水解原理为解答关键,注意掌握溶液酸碱性与溶液pH的计算方法,试题培养了学生的分析能力及化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Al | B. | Al(OH)3 | C. | AlCl3 | D. | Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
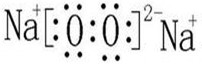 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对水加热到100℃,测得pH=6 | B. | 在水中滴入稀硫酸 | ||
| C. | 在水中加入小苏打 | D. | 在水中加入氯化铝固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应热就是反应发出的热量 | |
| B. | 由C(s)+$\frac{1}{2}$O2(g)═CO(g)的反应热为110.5kJ•mol-1,可知碳的燃烧热为110.5 kJ•mol-1 | |
| C. | 反应热的大小与反应物所具有的能量和生成物所具有的能量无关 | |
| D. | 1mol NaOH分别和1mol CH3COOH、1mol HNO3反应放出的热量:CH3COOH<HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
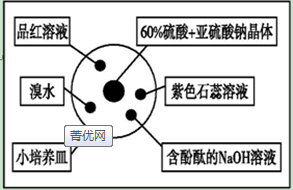
| A. | 品红溶液褪色 | B. | 溴水橙色褪去 | ||
| C. | 含酚酞的NaOH溶液红色变浅 | D. | 紫色石蕊溶液先变红后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 部分铁粉被氧化 | B. | 全部Fe3+被还原 | C. | 溶液质量减轻 | D. | 溶液质量增加 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com