
| A. | 对于一定条件下的某一可逆反应,用平衡浓度表示的平衡常数和用平衡分压表示的平衡常数,其数值不同,但意义相同,都随温度的升高而增大 | |
| B. | 结构式为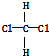 和 和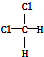 的物质互为同分异构体 的物质互为同分异构体 | |
| C. | 根据反应:NaA+CO2(少量)+H2O═HA+NaHCO3; 2NaB+CO2+H2O═2HB+Na2CO3,可以得出酸的强弱的顺序为:H2CO3>HA>HCO3->HB | |
| D. | 过硼酸钠晶体(NaBO3•4H2O)是一种优良的漂白剂,在70℃以上加热该晶体30.80克,反应后称量固体质量为27.20克,则该固体物质的化学式为NaBO3•H2O |
分析 A.若升高温度后平衡向着逆向移动,则平衡常数会减小;
B.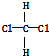 和
和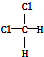 的分子式组成、结构完全相同,为同一种物质;
的分子式组成、结构完全相同,为同一种物质;
C.根据强酸制取弱酸原理分析;
D.过硼酸钠晶体(NaBO3•4H2O)的物质的量=$\frac{30.8g}{154g/mol}$=0.2mol,70℃以上质量变化为27.20g,质量变化30.8g-27.20g=3.6g,减少水的质量=$\frac{3.6g}{18g/mol}$=0.2mol,据此分析判断得到化学式.
解答 解:A.对于一定条件下的某一可逆反应,用平衡浓度表示的平衡常数和用平衡分压表示的平衡常数,其数值不同,但意义相同,但是温度升高后平衡常数不一定增大,如放热反应中,升高温度后平衡向着逆向移动,平衡常数减小,故A错误;
B.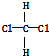 和
和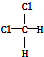 中氯原子连接在同一碳原子上,为四面体构型,不存在同分异构体,为同一物质,故B错误;
中氯原子连接在同一碳原子上,为四面体构型,不存在同分异构体,为同一物质,故B错误;
C.根据反应NaA+CO2(少量)+H2O═HA+NaHCO3可知酸性H2CO3>HA,根据反应2NaB+CO2+H2O═2HB+Na2CO3可知酸性HCO3->HB,则酸的强弱的顺序为:H2CO3>HA>HCO3->HB,故C正确;
D.过硼酸钠晶体(NaBO3•4H2O)的物质的量=$\frac{30.8g}{154g/mol}$=0.2mol,70℃以上质量变化为27.20g,质量变化30.8g-27.20g=3.6g,减少水的质量=$\frac{3.6g}{18g/mol}$=0.2mol,则1molNaBO3•4H2O失去水1mol,则T2℃时所得晶体的化学式为NaBO3•3H2O,故D错误;
故选C.
点评 本题考查较为综合,涉及化学平衡的影响因素、酸性强弱比较、同分异构体判断、分子式确定的计算等知识,题目难度中等,注意掌握同分异构体的概念及判断方法,A为易错点,注意温度升高后平衡常数不一定增大,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 在轮船水线以下的船体装上一定数量的锌块 | |
| B. | 在金属表面进行电镀 | |
| C. | 在一定条件下对金属进行处理,在其表面形成一层致密的氧化膜 | |
| D. | 将铁闸门与直流电源的正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 钴(Co)及其化合物在磁性材料、电池材料、超硬材料及催化剂等领域有广泛应用.已知钴属于铁系元素,其单质与化合物的性质与铁相似,其常见化合价有+2和+3.请回答下列问题:
钴(Co)及其化合物在磁性材料、电池材料、超硬材料及催化剂等领域有广泛应用.已知钴属于铁系元素,其单质与化合物的性质与铁相似,其常见化合价有+2和+3.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
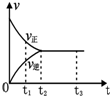 如图是可逆反应N2(g)+3H2(g)?2NH3(g)在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
如图是可逆反应N2(g)+3H2(g)?2NH3(g)在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )| A. | t1时,只有正反应在不断进行,速率在逐渐减小 | |
| B. | t2时,反应到达限度,在此条件下N2的转化率达到最大 | |
| C. | t2-t3,反应不再发生,各物质的物质的量保持恒定 | |
| D. | t3以后,N2(g)、H2(g)、NH3(g)的物质的量浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
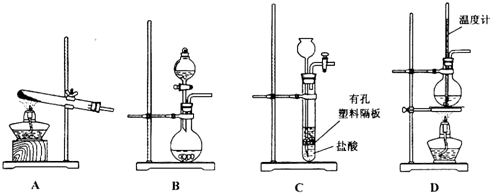
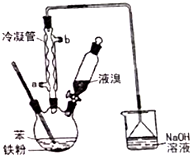 溴苯是一种化工原料,实验室用苯和液溴合成溴苯的装置示意图如图.(夹持仪器已略去)
溴苯是一种化工原料,实验室用苯和液溴合成溴苯的装置示意图如图.(夹持仪器已略去) +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr,反应过程中烧瓶内有白雾产生,是因为生成HBr了气体.
+HBr,反应过程中烧瓶内有白雾产生,是因为生成HBr了气体.| 苯 | 溴苯 | |
| 沸点/℃ | 80 | 156 |
| 水中溶解度 | 微溶 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
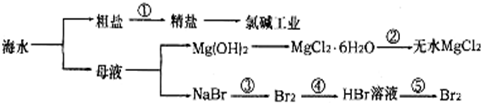
| A. | 过程①需要加入化学试剂、沉淀、过滤等操作 | |
| B. | 由“母液→无水MgCl2”一系列变化中未涉及氧化还原反应 | |
| C. | 工业上一般用电解氯化镁溶液制取Mg单质 | |
| D. | 反应③和⑤均可由下列反应实现:2Br-+Cl2=Br2+2Cl-,该反应属于置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大反应体系的压强,平衡后SO2的浓度、转化率、体积分数都增加 | |
| B. | 当单位时间内消耗SO2的物质的量和生成SO3的物质的量相同时,反应达到平衡状态 | |
| C. | 充入SO3气体,体系压强增大,平衡向右移动 | |
| D. | 升高温度,平衡向左移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com