
| A. | 该电池不能用水溶液作为电解质 | |
| B. | 放电时,Li+在电解质中由负极向正极迁移 | |
| C. | 充电时,若转移1 mol e-,阴极电极将增重7g | |
| D. | 放电时,正极的电极反应式为AlLi-e-═Li++Al |
分析 A.Li极易和水反应生成LiOH;
B、原电池中阳离子向正极移动;
C、阴极锂离子发生还原反应,电极反应为:Al+Li++e-═AlLi;
D、放电时正极发生还原反应,负极发生氧化反应.
解答 解:A.Li极易和水反应生成LiOH,所以不能用水溶液作电解质溶液,故A正确;
B、原电池中阳离子向正极移动,所以Li+在电解质中由负极向正极迁移,故B正确;
C、阴极锂离子发生还原反应,电极反应为:Al+Li++e-═AlLi,所以转移1 mol e-,阴极电极将增重7g,故C正确;
D、放电时正极发生还原反应,负极发生氧化反应,所以负极的电极反应式为:AlLi-e-═Li++Al,故D错误;
故选D.
点评 本题考查化学电源新型电池,为高频考点,明确正负极的判断、离子移动方向即可解答,难点是电极反应式的书写,易错选项是A.


科目:高中化学 来源: 题型:选择题
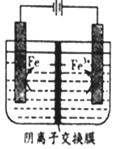
| A. | .阳极主要发生反应:Fe2+-e-═Fe3+ | |
| B. | 可用高纯铁电极作阴扱 | |
| C. | .电解液中的SO42-由右向左通过阴离子交换膜 | |
| D. | .电解法制备髙纯铁总反应:3Fe2+$\frac{\underline{\;通电\;}}{\;}$Fe+2Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将不可再生的天然气、石油、煤等化石燃料转化利用、提高利用率已成为当务之急.
将不可再生的天然气、石油、煤等化石燃料转化利用、提高利用率已成为当务之急.| 化学键 | C-H | C-F | H-F | F-F |
| 键能/(kJ.mol-1) | 414 | 489 | ? | 155 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 二氧化硫是大气的主要污染物之利用电化学原理可将SO2转化为主要化工原料-H2SO4,其工作原理如图所示下列说法正确的是( )
二氧化硫是大气的主要污染物之利用电化学原理可将SO2转化为主要化工原料-H2SO4,其工作原理如图所示下列说法正确的是( )| A. | 乙电极为正极,发生氧化反应 | |
| B. | H+从正极区通过交换膜移向负极区 | |
| C. | 甲电极的反应式为:SO2-2e-+2H2O═SO42-+4H+ | |
| D. | 乙电极上每消耗5.6LO2时,电路中通过1mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +4 | B. | +5 | C. | +6 | D. | +7 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 ,反应②的反应类型为消去反应.
,反应②的反应类型为消去反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 | B. | 5 | C. | 4 | D. | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +7、-1 | -2 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com