
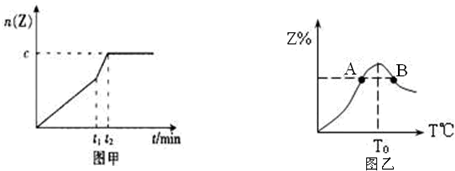
| △c |
| △t |
| ||
| 5min |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
| 催化剂 |
| △ |
| 催化剂 |
| △ |
| 催化剂 |
| △ |
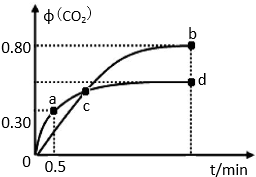
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| c(H+) | 6.3×10-9 | 6.3×10-8 | 6.3×10-7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | |
| 起始加料(mol) | x | y | z |
A、若
| ||
B、若
| ||
| C、若m+n<p,且a<0,则正反应一定可以自发进行 | ||
| D、若m+n>p,则正反应方向是熵减的方向 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、32 g氧气和臭氧的混合气体中所含的原子数为2N. |
| B、常温常压下,22.4LCO2含有的分子数目为NA |
| C、0.1mol OH-含有NA个电子 |
| D、2.4g金属镁与足量的盐酸反应,转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝粉与氧化铁的反应 |
| B、NH4Cl晶体与Ba(OH)2?8H2O晶体的反应 |
| C、锌片与稀硫酸反应 |
| D、钠与冷水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子式为C4H10烷烃的二氯取代物 |
| B、分子式为C3H9N的有机物,其中N原子以三个单键与其他原子相连 |
| C、乙苯的二氯取代物 |
| D、分子式为C4H8的有机物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com