
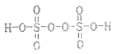
 £¬ĘäÖŠSŌŖĖŲµÄ»ÆŗĻ¼ŪĪŖ£ŗ+6£®¹żĮņĖįļ§£ØNH4£©2Fe£ØSO4£©2ČÜŅŗ½«Ce3+Ńõ»ÆCe4+ĪŖµÄĄė×Ó·½³ĢŹ½ĪŖ£ŗS2O42-+2Ce3+=2Ce4++2SO42-
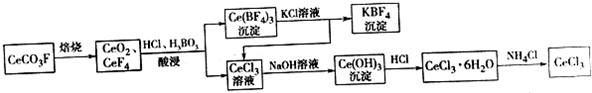
£¬ĘäÖŠSŌŖĖŲµÄ»ÆŗĻ¼ŪĪŖ£ŗ+6£®¹żĮņĖįļ§£ØNH4£©2Fe£ØSO4£©2ČÜŅŗ½«Ce3+Ńõ»ÆCe4+ĪŖµÄĄė×Ó·½³ĢŹ½ĪŖ£ŗS2O42-+2Ce3+=2Ce4++2SO42-·ÖĪö ĄūÓĆ·śĢ¼īęæó£ØÖ÷ŅŖ³É·ÖCeCO3F£©ĢįČ”CeCl3µÄŅ»ÖÖ¹¤ŅÕĮ÷³ĢĪŖ£¬CeCO3F±ŗÉÕµĆCeO2”¢CeF4£¬ÓĆŃĪĖįŗĶÅšĖįĖį½ž£¬¹żĀĖµĆ³ĮµķCe£ØBF£©4ŗĶCeCl3ĀĖŅŗ£¬Ce£ØBF£©4ÓėĀČ»Æ¼ŲČÜŅŗ·“Ó¦µĆµ½CeCl3ŗĶKBF£¬CeCl3ÓėĒ°ĆęĀĖŅŗÖŠCeCl3µÄŗĻ²¢ŌŁ¼ÓĒāŃõ»ÆÄĘ£¬µĆCe£ØOH£©3³Įµķ£¬Ce£ØOH£©3³ĮµķÓėŃĪĖį·“Ó¦æɵĆCeCl3•6H2O£¬¼ÓČČCeCl3•6H2OŗĶNH4ClµÄ¹ĢĢå»ģŗĻĪļæɵƵ½ĪŽĖ®CeCl3£¬
£Ø1£©øł¾Ż»ÆŗĻ¼Ū“śŹżŗĶĪŖ0ÅŠ¶Ļ£»
£Ø2£©ŌŚĖįŠŌĢõ¼žĻĀH2O2ÄÜ»¹ŌCeO2Éś³ÉCe3+£¬øł¾ŻŌŖĖŲŹŲŗćŗĶµēŗÉŹŲŗćŹéŠ“Ąė×Ó·½³ĢŹ½£»
£Ø3£©ĻņCe£ØBF4£©3ÖŠ¼ÓČėKClČÜŅŗÉś³ÉCeCl3ŗĶKBF£¬·ĄÖ¹Éś³ÉCe£ØBF4£©3³Įµķ£»
£Ø4£©ČÜŅŗÖŠµÄC£ØCe3+£©µČÓŚ1”Į10-5mol•L-1£¬æÉČĻĪŖCe3+³ĮµķĶźČ«£¬øł¾ŻKSP[Ce£ØOH£©3]=C£ØCe3+£©•C3£ØOH-£© æɼĘĖć³öČÜŅŗÖŠĒāŃõøłĄė×ÓµÄÅØ¶Č£¬½ų¶ųČ·¶ØPHÖµ£»
£Ø5£©NH4Cl¹ĢĢåŹÜČČ·Ö½ā²śÉśHCl£¬æÉŅŌŅÖÖĘCeCl3Ė®½ā£¬¾Ż“Ė“šĢā£»
£Ø6£©¢Łøł¾Ż»ÆŗĻ¼Ū“śŹżŗĶĪŖ0½įŗĻ¹ż¶žĮņĖį½į¹ūÅŠ¶Ļ£»¹żĮņĖįļ§[£ØNH4£©2 S2O4]½«Ce3+Ńõ»ÆĪŖCe4+£¬±¾Éķ±»»¹ŌĪŖĮņĖįøłĄė×Ó£»
¢Ś0.1000mol•l-1£ØNH4£©2Fe£ØSO4£©2±ź×¼ČÜŅŗĢå»ż25.00ml£¬ŗ¬ÓŠŃĒĢśĄė×ÓµÄĪļÖŹµÄĮæĪŖ2.5”Į10-3mol£¬øł¾Ż·“Ó¦Fe2++Ce4+ØTCe3++Fe3+£¬ĄūÓĆCeŌŖĖŲŹŲŗćæÉÖŖ£¬æɼĘĖć³öCeCl3µÄÖŹĮ棬½ų¶ųČ·¶Øѳʷ֊CeCl3µÄÖŹĮæ·ÖŹż£»
¢ŪČōŹ¹ÓĆ¾ĆÖĆµÄ£ØNH4£©2Fe£ØSO4£©2±ź×¼ČÜŅŗ½ųŠŠµĪ¶Ø£¬ÓÉÓŚŃĒĢśĄė×Ó±»æÕĘųÖŠŃõĘųŃõ»Æ£¬ĖłŅŌ»įĻūŗıź×¼ŅŗµÄĢå»żĪŖĘ«“󣬾Ż“Ė·ÖĪö£®
½ā“š ½ā£ŗ£Ø1£©øł¾Ż»ÆŗĻ¼Ū“śŹżŗĶĪŖ0æÉÖŖ£¬CeCO3FÖŠ£¬CeŌŖĖŲµÄ»ÆŗĻ¼ŪĪŖ+3¼Ū£¬
¹Ź“š°øĪŖ£ŗ+3£»
£Ø2£©Ļ”ĮņĖį”¢H2O2ÓėCeO2·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗH2O2+2CeO2+6H+=2Ce3++4H2O+O2”ü£¬
¹Ź“š°øĪŖ£ŗH2O2+2CeO2+6H+=2Ce3++4H2O+O2”ü£»
£Ø3£©ĻņCe£ØBF4£©3ÖŠ¼ÓČėKClČÜŅŗÉś³ÉCeCl3ŗĶKBF£¬ÕāŃł×öµÄÄæµÄŹĒ±ÜĆāČż¼ŪīęŅŌCe£ØBF4£©3³ĮµķµÄŠĪŹ½ĖšŹ§»ņ³żČ„BF4-»ņĢįøßCeCl3µÄ²śĀŹ£¬
¹Ź“š°øĪŖ£ŗ±ÜĆāČż¼ŪīęŅŌCe£ØBF4£©3³ĮµķµÄŠĪŹ½ĖšŹ§»ņ³żČ„BF4-»ņĢįøßCeCl3µÄ²śĀŹ£»
£Ø4£©ČÜŅŗÖŠµÄC£ØCe3+£©µČÓŚ1”Į10-5mol•L-1£¬æÉČĻĪŖCe3+³ĮµķĶźČ«£¬øł¾ŻKSP[Ce£ØOH£©3]=C£ØCe3+£©•C3£ØOH-£©=1”Į10-20æÉÖŖ£¬C£ØOH-£©=$\root{3}{\frac{1”Į1{0}^{-20}}{1”Į1{0}^{-5}}}$mol•L-1=1”Į10-5mol•L-1£¬“ĖŹ±ČÜŅŗµÄPHĪŖ9£¬
¹Ź“š°øĪŖ£ŗ9£»
£Ø5£©ÓÉÓŚNH4Cl¹ĢĢåŹÜČČ·Ö½ā²śÉśHCl£¬ŅÖÖĘCeCl3Ė®½ā£¬ĖłŅŌ¼ÓČČCeCl3•6H2OŗĶNH4ClµÄ¹ĢĢå»ģŗĻĪļæɵƵ½ĪŽĖ®CeCl3£¬
¹Ź“š°øĪŖ£ŗNH4Cl¹ĢĢåŹÜČČ·Ö½ā²śÉśHCl£¬ŅÖÖĘCeCl3Ė®½ā£»
£Ø6£©¢ŁÓÉøł¾Ż¹ż¶žĮņĖįµÄ½į¹¹æÉÖŖ£¬ÖŠ¼äĮ½øöOŹĒ-1¼Ū£Ø¹żŃõĮ“£©£¬Į½¶ĖµÄ6øöOŹĒ-2¼Ū£¬ĒāŌ×Ó+1¼Ū£¬»ÆŗĻ¼Ū“śŹżŗĶĪŖ0£¬ŌņĮņŌŖĖŲ+6¼Ū£»¹żĮņĖįļ§[£ØNH4£©2 S2O4]½«Ce3+Ńõ»ÆĪŖCe4+£¬±¾Éķ±»»¹ŌĪŖĮņĖįøłĄė×Ó£¬Ąė×Ó·½³ĢŹ½ĪŖ£ŗS2O42-+2Ce3+=2Ce4++2SO42-£»
¹Ź“š°øĪŖ£ŗ+6£»S2O42-+2Ce3+=2Ce4++2SO42-£»
¢Ś0.1000mol•l-1£ØNH4£©2Fe£ØSO4£©2±ź×¼ČÜŅŗĢå»ż25.00ml£¬ŗ¬ÓŠŃĒĢśĄė×ÓµÄĪļÖŹµÄĮæĪŖ2.5”Į10-3mol£¬øł¾Ż·“Ó¦Fe2++Ce4+ØTCe3++Fe3+£¬ĄūÓĆCeŌŖĖŲŹŲŗćæÉÖŖ£¬CeCl3µÄÖŹĮæĪŖ2.5”Į10-3mol”Į246.5g/mol=0.6163g£¬ĖłŅŌѳʷ֊CeCl3µÄÖŹĮæ·ÖŹżĪŖ$\frac{0.6163g}{0.7500g}$”Į100%=82.2%£¬
¹Ź“š°øĪŖ£ŗ82.2%£»
¢ŪČōŹ¹ÓĆ¾ĆÖĆµÄ£ØNH4£©2Fe£ØSO4£©2±ź×¼ČÜŅŗ½ųŠŠµĪ¶Ø£¬ÓÉÓŚŃĒĢśĄė×Ó±»æÕĘųÖŠŃõĘųŃõ»Æ£¬ĖłŅŌ»įĻūŗıź×¼ŅŗµÄĢå»żĪŖĘ«“ó£¬Ōņ²āµĆøĆCeCl3ѳʷµÄÖŹĮæ·ÖŹżĘ«“ó£¬
¹Ź“š°øĪŖ£ŗĘ«“ó£®
µćĘĄ ±¾Ģāæ¼²éĮĖĪļÖŹµÄÖʱø£¬Éę¼°¶Ō¹¤ŅÕĮ÷³ĢµÄĄķ½ā”¢Ńõ»Æ»¹Ō·“Ó¦”¢¶ŌĢõ¼žµÄæŲÖĘŃ”ŌńÓėĄķ½ā”¢ČܶȻżµÄ¼ĘĖćµČ£¬Ąķ½ā¹¤ŅÕĮ÷³ĢŌĄķŹĒ½āĢāµÄ¹Ų¼ü£¬ŹĒ¶Ōѧɜ×ŪŗĻÄÜĮ¦µÄ漲飬ŠčŅŖѧɜ¾ß±øŌśŹµµÄ»ł“”ÓėĮé»īŌĖÓĆÄÜĮ¦£¬ĢāÄæÄѶČÖŠµČ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | mgøĆ“Å»ĘĢśæóÖŠŗ¬+2¼ŪµÄĢś0.75mol | |
| B£® | 200mLŃĪĖįÖŠHClĪļÖŹµÄĮæÅضČĪŖ4.25mol•L-1 | |
| C£® | Éś³ÉµÄH2SĘųĢåŌŚ±ź×¼×“æöĻĀµÄĢå»żĪŖ16.8L | |
| D£® | øĆ“Å»ĘĢśæóÖŠFe1-nSµÄn=0.15 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® |  ½«ŗ£“ų×ĘÉÕ»Ņ»Æ | B£® |  ĀĮČČ·“Ó¦ | ||
| C£® |  ÖĘČ”ĒāŃõ»ÆŃĒĢś | D£® | 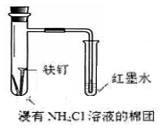 ŃéÖ¤ĢśµÄĪüŃõøÆŹ“ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
 |  |  | 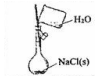 |
| A£®¶ĮȔȷ¶ØÖÕµćŹ±µÄŹż¾ŻĪŖ21.80mL | B£®ŹµŃéŹŅÖĘČ”°±Ęų | C£®ÓƱ½ŻĶČ”µāĖ®ÖŠµÄI2ŗ󣬷ÖŅŗ | D£®ÅäÖĆ0.10mol/L NaClČÜŅŗ |
| A£® | A | B£® | B | C£® | C | D£® | D |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
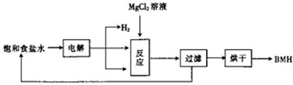 BMH{¼īŹ½“ĪĀČĖįĆ¾}[Mg2ClO£ØOH£©n•H2O]}ŹĒŅ»ÖÖ°×É«·ŪÄ©£®ÄŃČÜÓŚĖ®£¬ŹĒ³£ÓƵÄĪŽ»śæ¹¾ś¼Į£¬ĘäŅ»ÖÖÉś²ś¹¤ŅÕČēĶ¼ĖłŹ¾£®
BMH{¼īŹ½“ĪĀČĖįĆ¾}[Mg2ClO£ØOH£©n•H2O]}ŹĒŅ»ÖÖ°×É«·ŪÄ©£®ÄŃČÜÓŚĖ®£¬ŹĒ³£ÓƵÄĪŽ»śæ¹¾ś¼Į£¬ĘäŅ»ÖÖÉś²ś¹¤ŅÕČēĶ¼ĖłŹ¾£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | øĆĘųĢåµÄĦ¶ūÖŹĮæĪŖ34 | B£® | 500mlČÜŅŗĪļÖŹµÄĮæÅضČĪŖ2mol/L | ||
| C£® | ±źæöĻĀøĆĘųĢåµÄĦ¶ūĢå»żĪŖ22.4 L | D£® | 17æĖøĆĘųĢåĪļÖŹµÄĮæĪŖ0.5mol |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¼ĘĖćĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
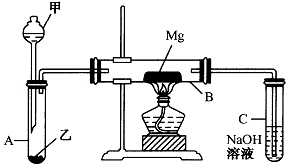 ŅŃÖŖSiO2”¢SO2ŗĶCO2¶¼ŹĒĖįŠŌŃõ»ÆĪļ£¬»ÆѧŠŌÖŹ¾ßÓŠŅ»¶ØµÄĻąĖĘŠŌ£»MgŗĶNaµÄ»ÆѧŠŌÖŹŅ²¾ßÓŠŅ»¶ØĻąĖĘŠŌ£®
ŅŃÖŖSiO2”¢SO2ŗĶCO2¶¼ŹĒĖįŠŌŃõ»ÆĪļ£¬»ÆѧŠŌÖŹ¾ßÓŠŅ»¶ØµÄĻąĖĘŠŌ£»MgŗĶNaµÄ»ÆѧŠŌÖŹŅ²¾ßÓŠŅ»¶ØĻąĖĘŠŌ£®²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com