
ΓΨΧβΡΩΓΩΑ¥“Σ«σΧνΩ’
Θ®1Θ©”–œ¬Ν–Έο÷ ΘΚΔΌΆ≠ΘΜΔΎ ·Μ“Υ°ΘΜΔέCO2ΘΜΔήFeΘ®OHΘ©3»ή“ΚΘΜΔίCaOΘΜΔόΕΙΫ§ΓΘΤδ÷– τ”ΎΫΚΧεΒΡ «_____Θ®Χν–ρΚ≈Θ§œ¬Ά§Θ©Θ§ τ”ΎΦν–‘―θΜ·ΈοΒΡ «_____
Θ®2Θ©‘Ύ±ξΉΦΉ¥Ωωœ¬Θ§35.5g¬»ΤχΒΡΧεΜΐ «_____LΘ°ΫΪΤδ”κ«βΤχΜ·ΚœΘ§–η«βΤχΒΡΈο÷ ΒΡΝΩ «_____molΘ§ΫΪ…ζ≥…ΒΡΤχΧε»ή”ΎΥ°Θ§≈δ≥…500mL»ή“ΚΘ§‘ρΗΟ»ή“Κ÷–»ή÷ ΒΡΈο÷ ΒΡΝΩ≈®Ε» «_____mol/L
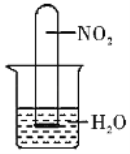
Θ®3Θ©»γΆΦΥυ ΨΘ§ΫΪ≥δ¬ζNO2ΤχΧεΒΡ ‘ΙήΒΙΩέ‘ΎΥ°≤έ÷–Θ§Ιέ≤λΒΫ ‘ΙήΡΎΤχΧε―’…Ϊ”…_____…Ϊ÷πΫΞ±δΈΣΈό…ΪΘ§Ήν÷’ ‘ΙήΡΎ“ΚΟφ…œ…ΐ÷Ν ‘Ιή»ίΜΐΒΡ_____¥ΠΘ®ΧνΖ÷ ΐΘ©
ΓΨ¥πΑΗΓΩΔήΔό Δί 11.2 0.5 2 ΚλΉΊ ![]()
ΓΨΫβΈωΓΩ
Θ®1Θ©ΔΌΆ≠ «ΒΞ÷ ΘΜΔΎ ·Μ“Υ° «»ή“ΚΘΜΔέCO2 «¥ΩΨΜΈοΘ§ΈΣΥα–‘―θΜ·ΈοΘΜΔήFeΘ®OHΘ©3»ή“ΚΖ÷…Δ÷ ΝΘΕ»Ϋι”Ύ1©¹100nm÷°Φδ «ΫΚΧεΘΜΔίCaOΡήΙΜ”κΥαΖ¥”Π…ζ≥…―ΈΚΆΥ°ΈΣΦν–‘―θΜ·ΈοΘΜΔόΕΙΫ§Θ§Ζ÷…Δ÷ ΝΘΕ»Ϋι”Ύ1©¹100nm÷°Φδ «ΫΚΧεΘΜ
Θ®2Θ©ΗυΨίΙΪ Ϋn=![]() ΚΆc=
ΚΆc=![]() ΦΤΥψΘΜ
ΦΤΥψΘΜ
Θ®3Θ©ΗυΨίΖΫ≥Χ Ϋ3NO2+H2OΘΫ2HNO3+NOΩ…÷ΣΘ§3ΧεΜΐΕΰ―θΜ·ΒΣ”κΥ°Ζ¥”Π…ζ≥…1ΧεΜΐ“Μ―θΜ·ΒΣΘ§“Μ―θΜ·ΒΣ≤Μ»ή”ΎΥ°Θ§”…¥ΥΫβ¥πΓΘ
Θ®1Θ©ΔΌΆ≠ «ΒΞ÷ ΘΜΔΎ ·Μ“Υ° «»ή“ΚΘΜΔέCO2 «¥ΩΨΜΈοΘ§ΈΣΥα–‘―θΜ·ΈοΘΜΔήFeΘ®OHΘ©3»ή“ΚΖ÷…Δ÷ ΝΘΕ»Ϋι”Ύ1©¹100nm÷°Φδ «ΫΚΧεΘΜΔίCaOΡήΙΜ”κΥαΖ¥”Π…ζ≥…―ΈΚΆΥ°ΈΣΦν–‘―θΜ·ΈοΘΜΔόΕΙΫ§Θ§Ζ÷…Δ÷ ΝΘΕ»Ϋι”Ύ1©¹100nm÷°Φδ «ΫΚΧεΘΜΥυ“‘ τ”ΎΫΚΧεΒΡ «ΔήΔόΘ§ τ”ΎΦν–‘―θΜ·ΈοΒΡ « ΔίΘΜ
Θ®2Θ©‘Ύ±ξΉΦΉ¥Ωωœ¬Θ§35.5g¬»ΤχΒΡΧεΜΐΘΚ![]() ΓΝ22.4L/molΘΫ0.5molΘΜ“άΨίΖΫ≥Χ ΫΘΚH2+Cl2
ΓΝ22.4L/molΘΫ0.5molΘΜ“άΨίΖΫ≥Χ ΫΘΚH2+Cl2 ![]() 2HClΘ§0.5mol¬»Τχ”κ0.5mol«βΤχΖ¥”Π…ζ≥…1mol¬»Μ·«βΘ§¬»Μ·«β»ή”ΎΥ°
2HClΘ§0.5mol¬»Τχ”κ0.5mol«βΤχΖ¥”Π…ζ≥…1mol¬»Μ·«βΘ§¬»Μ·«β»ή”ΎΥ°![]() ΘΫ2mol/LΘΜ
ΘΫ2mol/LΘΜ
Θ®3Θ©NO2ΤχΧεΈΣΚλΉΊ…ΪΘ§Εΰ―θΜ·ΒΣΤχΧε“Ή”κΥ°Ζ¥”Π…ζ≥…œθΥαΘ®HNO3Θ©ΚΆ“Μ―θΜ·ΒΣΘ§3NO2+H2OΘΫ2HNO3+NOΘ§NOΈΣΈό…ΪΘ§Υυ“‘ΤχΧε―’…Ϊ”…ΚλΉΊ…Ϊ÷πΫΞ±δΈΣΈό…ΪΘ§“άΨίΖΫ≥Χ Ϋ3ΧεΜΐΕΰ―θΜ·ΒΣ”κΥ°Ζ¥”Π…ζ≥…1ΧεΜΐ“Μ―θΜ·ΒΣΘ§“Μ―θΜ·ΒΣ≤Μ»ή”ΎΥ°Θ§Υυ“‘Ζ¥”ΠΚσ»ή“ΚΧεΜΐ’Φ ‘ΙήΧεΜΐΒΡ![]() ΓΘ
ΓΘ


 ‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗ
‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗ
| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΫώΡξ «Ο≈ΫίΝ–ΖρΖΔœ÷‘ΣΥΊ÷ήΤΎ¬… 150 ÷ήΡξΓΘœ¬±μ «‘ΣΥΊ÷ήΤΎ±μΒΡ“Μ≤ΩΖ÷Θ§WΓΔXΓΔYΓΔZ ΈΣΕΧ÷ήΤΎ÷ςΉε‘ΣΥΊΘ§W ‘≠Ή”ΉνΆβ≤ψΒγΉ” ΐ «ΤδΡΎ≤ψΒγΉ” ΐΒΡ 3 ±ΕΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «Θ® Θ©
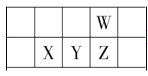
A.‘≠Ή”ΑκΨΕΘΚW>X
B.ΉνΗΏΦέ―θΜ·ΈοΒΡΥ°Μ·ΈοΥα–‘ΘΚY>Z
C.ΤχΧ§«βΜ·ΈοΖ–ΒψΘΚZ>W
D.ΤχΧ§«βΜ·Έο»»Έ»Ε®–‘ΘΚZ<W
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ“ΜΕ®ΧθΦΰœ¬Θ§‘ΎΟή±’»ίΤς÷–Θ§Ρή±μ ΨΖ¥”ΠX(g)ΘΪ2Y(g) ![]() 2Z(g)“ΜΕ®¥οΒΫΜ·―ßΤΫΚβΉ¥Χ§ΒΡ «(ΓΓΓΓ)
2Z(g)“ΜΕ®¥οΒΫΜ·―ßΤΫΚβΉ¥Χ§ΒΡ «(ΓΓΓΓ)
ΔΌXΓΔYΓΔZΒΡΈο÷ ΒΡΝΩ÷°±» «1ΓΟ2ΓΟ2
ΔΎXΓΔYΓΔZΒΡ≈®Ε»≤Μ‘ΌΖΔ…ζ±δΜ·
Δέ»ίΤς÷–ΒΡ―Ι«Ω≤Μ‘ΌΖΔ…ζ±δΜ·
ΔήΒΞΈΜ ±ΦδΡΎ…ζ≥…n mol ZΘ§Ά§ ±…ζ≥…2n mol Y
A. ΔΌΔΎB. ΔΌΔήC. ΔΎΔέD. ΔέΔή
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ»γΆΦ «≈δ÷Τ“ΜΕ®Έο÷ ΒΡΝΩ≈®Ε»»ή“ΚΒΡΙΐ≥Χ Ψ“βΆΦΓΘœ¬Ν–ΥΒΖ®÷–¥μΈσΒΡ «( )
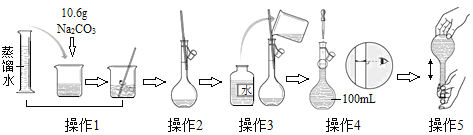
A.Υυ≈δ÷ΤΒΡNa2CO3»ή“ΚΒΡΈο÷ ΒΡΝΩ≈®Ε»ΈΣ1.0 mol ΓΛ LΘ≠1
B.≤ΌΉς2 «ΫΪ»ήΫβ≤ΔΖ≈÷Ο÷Ν “Έ¬ΒΡNa2CO3»ή“ΚΉΣ“ΤΒΫ»ίΝΩΤΩ÷–
C.≤ΌΉς4»γΙϊ―ω ”Θ§Μα Ι≈δΒΟ»ή“ΚΒΡ≈®Ε»ΤΪΒΆ
D.≤ΌΉς5÷–Θ§Ε®»ί“Γ‘»ΚσΖΔœ÷“ΚΟφΒΆ”ΎΩΧΕ»œΏΘ§ΦΧ–χΦ”Υ°÷Ν“ΚΟφ”κΩΧΕ»œΏœύ«–
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΡ≥Ζ¥”ΠΫχ––Ιΐ≥Χ÷–,ΗςΈο÷ Έο÷ ΒΡΝΩΒΡ±δΜ·«ιΩω»γΆΦΥυ ΨΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
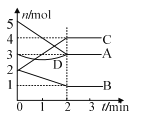
A. CΓΔD «…ζ≥…Έο
B. Ζ¥”ΠΒΡΖΫ≥Χ ΫΈΣ2A + B![]() 2C
2C
C. 2 minΚσΗςΈο÷ ΒΡΝΩ≤Μ‘Ό±δΜ·
D. ΗΟΖ¥”Π≤Μ «Ω…ΡφΖ¥”Π
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ»γΆΦΥυ ΨΘ§œρAΚΆB÷–ΕΦ≥δ»Υ2molXΚΆ2molYΘ§Τπ ΦVA=0.8a LΘ§VB=a L±Θ≥÷Έ¬Ε»≤Μ±δΘ§‘Ύ”–¥ΏΜ·ΦΝΒΡΧθΦΰœ¬Θ§ΝΫ»ίΤς÷–ΗςΉ‘ΖΔ…ζœ¬Ν–Ζ¥”ΠΘΚX(g)+Y(g)![]() 2Z(g)+W(g)¥οΒΫΤΫΚβ ±Θ§VA=0.9a LΘ§‘ρœ¬Ν–ΥΒΖ®¥μΈσΒΡ « ( )
2Z(g)+W(g)¥οΒΫΤΫΚβ ±Θ§VA=0.9a LΘ§‘ρœ¬Ν–ΥΒΖ®¥μΈσΒΡ « ( )
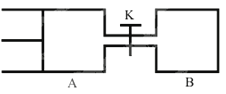
A. ΝΫ»ίΤς÷–¥οΒΫΤΫΚβΒΡ ±ΦδA<B
B. ¥ρΩΣK¥οΒΫ–¬ΤΫΚβΚσΘ§…ΐΗΏB»ίΤςΈ¬Ε»,A»ίΤςΧεΜΐœύ±»‘≠ΤΫΚβΉ¥Χ§ ±“ΜΕ®‘ω¥σ
C. A»ίΤς÷–XΒΡΉΣΜ·¬ ΈΣ25%Θ§«“±»B»ίΤς÷–ΒΡXΒΡΉΣΜ·¬ –Γ
D. ¥ρΩΣK“ΜΕΈ ±Φδ¥οΤΫΚβ ±Θ§AΒΡΧεΜΐΈΣ0.8a LΘ®Ν§Ά®Ιή÷–ΒΡΤχΧεΧεΜΐ≤ΜΦΤΘ©
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ¬»Φν≥ßΒγΫβ±ΞΚΆ ≥―ΈΥ°÷Τ»ΓΒΡΙΛ“’Νς≥ΧΆΦ»γœ¬ΘΚ
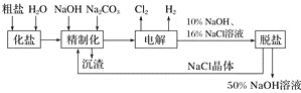
(1)‘ΎΒγΫβΙΐ≥Χ÷–Θ§”κΒγ‘¥’ΐΦΪœύΝ§ΒΡΒγΦΪ…œΥυΖΔ…ζΖ¥”ΠΒΡΒγΦΪΖ¥”Π ΫΈΣ______________Θ§”κΒγ‘¥ΗΚΦΪœύΝ§ΒΡΒγΦΪ…œΥυΖΔ…ζΖ¥”ΠΒΡΒγΦΪΖ¥”Π ΫΈΣ__________________ΓΘ
(2)ΙΛ“Β ≥―ΈΚ§Ca2ΘΪΓΔMg2ΘΪΒ»‘”÷ Θ§ΨΪ÷ΤΙΐ≥Χ÷–ΖΔ…ζΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣ________________________________________________________________________ΓΘ
(3)»γΙϊ¥÷―Έ÷–![]() Κ§ΝΩΫœΗΏΘ§±Ί–κΧμΦ”±Β ‘ΦΝ≥ΐ»Ξ
Κ§ΝΩΫœΗΏΘ§±Ί–κΧμΦ”±Β ‘ΦΝ≥ΐ»Ξ![]() Θ§ΗΟ±Β ‘ΦΝΩ…“‘ «______(ΧνΉ÷ΡΗ)ΓΘ
Θ§ΗΟ±Β ‘ΦΝΩ…“‘ «______(ΧνΉ÷ΡΗ)ΓΘ
aΓΔBa(OH)2ΓΓΓΓΓΓΓΓbΓΔBa(NO3)2ΓΓΓΓΓΓΓΓcΓΔBaCl2
(4)ΈΣ”––ß≥ΐ»ΞCa2ΘΪΓΔMg2ΘΪΓΔ![]() Θ§Φ”»κ ‘ΦΝΒΡΚœάμΥ≥–ρΈΣ________ΓΘ
Θ§Φ”»κ ‘ΦΝΒΡΚœάμΥ≥–ρΈΣ________ΓΘ
aΓΔœ»Φ”NaOHΘ§ΚσΦ”Na2CO3Θ§‘ΌΦ”±Β ‘ΦΝ
bΓΔœ»Φ”NaOHΘ§ΚσΦ”±Β ‘ΦΝΘ§‘ΌΦ”Na2CO3
cΓΔœ»Φ”±Β ‘ΦΝΘ§ΚσΦ”NaOHΘ§‘ΌΦ”Na2CO3
(5)Ά――ΈΙΛ–ρ÷–άϊ”ΟNaOHΚΆNaCl‘Ύ»ήΫβΕ»…œΒΡ≤ν“λΘ§Ά®Ιΐ________ΓΔά以ΓΔΫαΨßΓΔ________(Χν–¥≤ΌΉςΟϊ≥Τ)≥ΐ»ΞNaClΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΑ―NaOHΓΔMgCl2ΓΔAlCl3»ΐ÷÷ΙΧΧεΉι≥…ΒΡΜλΚœΈο»ή”ΎΉψΝΩΥ°Κσ≤ζ…ζ1.16gΑΉ…Ϊ≥ΝΒμΘ§‘ΎΥυΒΟΒΡΉ«“Κ÷–÷πΒΈΦ”»κ1 molL-1 HCl»ή“ΚΘ§Φ”»κHCl»ή“ΚΒΡΧεΜΐ”κ…ζ≥…≥ΝΒμΒΡ÷ ΝΩΙΊœΒ»γΆΦΥυ ΨΓΘ
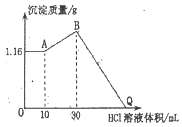
«κΜΊ¥πœ¬Ν–Έ Χβ:
(1)BΒψΒΡ≥ΝΒμΈοΒΡΜ·―ß ΫΈΣ_____
(2)–¥≥ωΜλΚœΈο»ή”ΎΥ° ±ΖΔ…ζΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ Ϋ_____
(3)‘≠ΜλΚœΈο÷–MgCl2ΒΡΈο÷ ΒΡΝΩΈΣ_____
(4)‘≠ΙΧΧεΜλΚœΈο÷–NaOHΒΡ÷ ΝΩΈΣ_____
(5)QΒψΦ”»κHCl»ή“ΚΒΡΧεΜΐΈΣ_____
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΑΌΕ»÷¬–≈ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com