
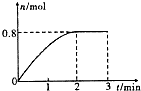
 一定条件下,将3molA和l mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?C(g)+2D(s).2min末该反应达到平衡,生成D的物质的量随时间变化情况如图.下列判断正确的是( )
一定条件下,将3molA和l mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?C(g)+2D(s).2min末该反应达到平衡,生成D的物质的量随时间变化情况如图.下列判断正确的是( )| A. | 若混合气体的密度不再改变时,该反应不一定达到平衡状态 | |
| B. | 2 min后,加压会使正反应速率加快,逆反应速率变慢,平衡正向移动 | |
| C. | 反应过程中A和B的转化率之比为3:1 | |
| D. | 开始到平衡,用A表示该反应的化学反应速率为0.3mol•L-1•min-1 |
分析 A、反应前后气体质量和气体体积发生变化,若混合气体的密度不再改变时,该反应一定达到平衡状态;
B、2min后,加压会使正、逆反应速率都加快,平衡正向移动;
C、将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,反应比和起始量之比相同,所以反应过程中A和B的转化率相同;
D、根据D的物质的量的变化计算A的物质的量的变化,再根据v=$\frac{\frac{△n}{V}}{△t}$计算v(A).
解答 解:A、反应生成固体D,气体质量和气体体积发生变化,若混合气体的密度不再改变时,该反应一定达到平衡状态,故A错误;
B、2min后,加压会使正、逆反应速率都加快,平衡正向移动,故B错误;
C、将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,反应比和起始量之比相同,所以反应过程中A和B的转化率之比为1:1,故C错误;
D、2min内生成0.8mol D,则消耗A的物质的量为1.2mol,故2 min内A的反应速率v(A)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{1.2mol}{2L}}{2min}$=0.3 mol•(L•min)-1,故D正确;
故选D.
点评 本题考查了化学平衡标志分析,平衡常数概念的计算应用,主要是一些反应速率、化学平衡的因素分析判断,掌握基础是关键,题目难度中等.


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| IE1 | IE2 | IE3 | IE4 | IE5 | IE6 |
| 11 | 24 | 48 | 64 | 392 | 490 |
| A. | B | B. | C | C. | N | D. | O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 通过煤的气化和液化,使碳及其化合物得以广泛应用.
通过煤的气化和液化,使碳及其化合物得以广泛应用.| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H2O)/mol | 0.600 | 0.520 | 0.450 | 0.350 | 0.350 |
| n(CO)/mol | 0.400 | 0.320 | 0.250 | 0.150 | 0.150 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该物质分子式为C7H10O5 | |
| B. | 该物质与乙酸互为同系物 | |
| C. | 该物质能与乙醇发生酯化反应 | |
| D. | 1mol该物质与Na反应时,最多消耗Na 4mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com