

| A. | 难溶于水,易溶于乙醚 | |
| B. | 可与NaOH溶液发生水解反应 | |
| C. | 其同分异构体不可能有芳香族化合物 | |
| D. | 分子中含有的官能团是过氧键、醚键和酯基 |
分析 A.该分子中没有亲水基,只有憎水基,根据相似相溶原理判断其溶解性;
B.酯基能发生水解反应;
C.有机物含有5个环,1个C=O键,不饱和度为6,苯环的不饱和度是4;
D.该分子中的官能团是酯基、醚键和过氧键.
解答 解:A.该分子中没有亲水基,只有憎水基,根据相似相溶原理知,该物质不易溶于水,易溶于有机溶剂乙醚,故A正确;
B.酯基能发生水解反应,该分子中含有酯基,所以能与NaOH溶液发生水解反应,故B正确;
C.有机物含有5个环,1个C=O键,不饱和度为6,苯环的不饱和度是4,所以该有机物的同分异构体中可能含有苯环,故C错误;
D.根据图知,该分子中的官能团是酯基、醚键和过氧键三种官能团,故D正确;
故选C.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生分析判断能力,明确官能团的性质是解本题关键,注意不饱和度的计算方法,环的不饱和度是1、双键的不饱和度是1,题目难度不大.


 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:选择题
| A. | 将NH4Cl溶液蒸干灼烧制备NH4Cl固体 | |
| B. | 只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液 | |
| C. | 用可见光束照射以区别溶液和胶体 | |
| D. | 用分液的方法分离酒精和水的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2的电子式: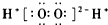 | |
| B. | CO2分子的结构式:O═C═O | |
| C. | 原子核内有8个中子的碳原子:${\;}_8^{14}C$ | |
| D. | 氯化钾的分子式:KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的密度随核电荷数的增加逐渐减小 | |
| B. | 单质的颜色随核电荷数的增加而逐渐变浅 | |
| C. | 单质的氧化性随核电荷数的增加而逐渐减弱 | |
| D. | 氢化物的稳定性随核电荷数的增加逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
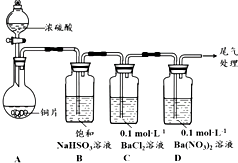
| 序号 | 实验操作 | 实验现象 |
| 1 | 取0.3g 纯净Na2SO3固体,向其中加入10mL2mol•L-1盐酸,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,4min后,溶液变浑浊 |
| 2 | 取0.3g 纯净Na2SO3固体,向其中加入10mL 2mol•L-1 HNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,2h后,溶液变浑浊 |
| 3 | 取0.3g 纯净Na2SO3固体,向其中加入10mL 浓HNO3,再滴入4滴BaCl2溶液 | 产生红棕色气体;滴入BaCl2溶液后,溶液立即产生大量白色沉淀 |
| 序号 | 实验操作 | 实验现象 |
| 4 | 取固体混合物,向其中加入10mL2mol•L-1 HNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,20min后,溶液变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①②③ | C. | ②③④ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸 | H2CO3 | 水杨酸(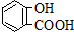 ) ) |
| 电离平衡常数(25℃) | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka1=1.3×10-3 Ka2=1.1×10-11 |
| A. | 常温下,等浓度、等体积的NaHCO3溶液pH小于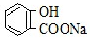 溶液pH 溶液pH | |
| B. | 常温下,等浓度、等体积的Na2CO3溶液和 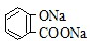 溶液中所含离子总数前者小于后者 溶液中所含离子总数前者小于后者 | |
| C. |  +2NaHCO3→ +2NaHCO3→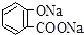 +2H2O+2CO2↑ +2H2O+2CO2↑ | |
| D. | 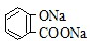 最多可与2molCO2反应 最多可与2molCO2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.4gCu与足量的硫反应,转移电子数为0.2 NA | |
| B. | 通常情况下,32g O2和O3的混合气体含有的分子总数小于NA | |
| C. | 6.4g CaC2中含有的离子总数目为0.3NA | |
| D. | 标准状况下,将分子总数为NA的NH3和Cl2充分混合后,所得混合气体体积约为22.4L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com