
| A. | H2RO3的酸性大于H2CO3的酸性 | B. | 最高价氧化物不与任何酸反应 | ||
| C. | 单质常用作半导体材料和光导纤维 | D. | 在自然界中仅以化合态形式存在 |
分析 短周期非金属元素R的原子核外最外层电子数是次外层电子数的一半,若为第三周期元素,则最外层电子数为4,R为Si元素,若为第二周期元素,R为Li,为金属元素,不符合题意,结合R为Si及同主族元素化合物的性质来解答.
解答 解:由上述分析可知,R为Si,则
A.非金属性C>Si,则H2RO3的酸性小于H2CO3的酸性,故A错误;
B.二氧化硅与HF酸反应,故B错误;
C.Si用作半导体材料,二氧化硅作光导纤维的材料,故C错误;
D.Si为亲氧元素,则在自然界中仅以化合态形式存在,故D正确;
故选D.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构、元素的位置来推断元素为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ≡C-CH3的分子结构,下列说法正确的是( )
≡C-CH3的分子结构,下列说法正确的是( )| A. | 除苯环外的其余碳原子有可能都在一条直线上 | |
| B. | 除苯环外的其余碳原子不可能都在一条直线上 | |
| C. | 12个碳原子不可能都在同一平面上 | |
| D. | 所有原子有可能都在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| CO2体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14 g分子式为CnH2n的烃中含有的C-H键的数目为2NA | |
| B. | 2.24 L(标准状况)甲烷与7.1 g氯气在光照条件下反应得到CH3Cl的分子数为0.1NA | |
| C. | 含有10.7 g Fe(OH)3的氢氧化铁胶体中,氢氧化铁胶粒总数为0.1NA | |
| D. | 100g 17%的氨水,溶液中含有的NH3分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
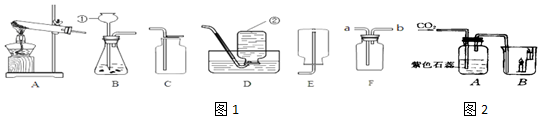
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
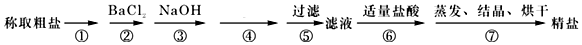
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com