
【题目】2018年12月8日,凌晨2时23分,我国在西昌卫星发射中心,嫦娥四号探测器搭载长征三号乙运载火箭成功发射,实现了世界首次月球背面软着陆和巡视探测,被认为是中国在工程技术和空间科学方面的双重跨越和创新。
I.肼(N2H4)又称联氨,常温时是一种可燃性的液体,可用作火箭燃料。
(1)已知在25℃、101kPa时,16g N2H4在氧气中完全燃烧生成氮气,放出312kJ的热量,则N2H4完全燃烧的热化学方程式是___________________________________________________。
II.如下图所示,某研究性学习小组利用上述燃烧原理设计一个肼(N2H4)─空气燃料电池(如图甲)并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
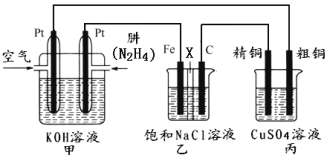
根据要求回答相关问题:
(2)甲装置中正极的电极反应式为:______________________________________。
(3)检验乙装置中石墨电极反应产物的方法是:___________________________。
(4)如果电解后丙装置精铜质量增加3.2g,则理论上甲装置中肼消耗质量为___________g。
III.对金属制品进行抗腐蚀处理,可延长其使用寿命。该研究性学习小组又以肼(N2H4)─空气燃料电池为电源对铝材表面进行如下处理:
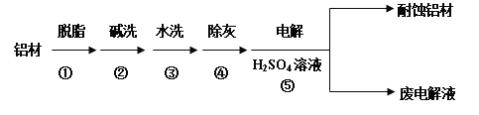
(5)流程⑤中以铝材为阳极,在H2SO4 溶液中电解,最终可在铝材表面形成氧化膜,该电解的阳极电极反应式为__________________________________。
(6)取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,其反应的离子方程式是__________________________________________________________。
【答案】N2H4(l )+O2(g)=N2(g)+2H2O(l) ΔH=-624 kJ·mol-1
或1/2N2H4(l )+1/2O2(g)=1/2N2(g)+H2O(l) ΔH=-312 kJ·mol-1 O2+2H2O+4e-= 4OH-或O2+2H2O+4e- → 4OH- 将湿润的碘化钾淀粉试纸放在C电极附近,看试纸是否变蓝色 0.8 2Al+3H2O-6e-= Al2O3+6H+;或2Al+3H2O → Al2O3+6H++6e- Al3++3HCO3-=Al(OH)3↓+3CO2↑
【解析】
(1)依据热化学方程式书写方法,标注物质聚集状态和对应量的反应热写出热化学方程式;
(2) 甲装置是燃料电池,正极上氧化剂得电子发生还原反应;
(3)乙装置中石墨电极是阳极,氯离子放电生成氯气;
(4)根据转移电子相等,列出关系式:N2H4~2Cu进行分析求解;
(5) 流程⑤中阳极上铝失电子和水反应生成氧化铝;
(6)铝失电子生成铝离子进入溶液,废电解液中含有铝离子,铝离子和碳酸氢根离子发生双水解反应生成氢氧化铝沉淀。
(1)16.0g气态肼(N2H4)物质的量为0.5mol,在氧气中完全燃烧生成氮气和液态水,放出热量312kJ,1mol气态肼(N2H4)燃烧放热624KJ,反应的热化学方程式为:N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-624KJ/mol;
(2) 甲装置是燃料电池,正极上氧气得电子发生还原反应,电极反应式为:O2+4e-+2H2O=4OH-;
(3) 乙装置中石墨电极是阳极,氯离子放电生成氯气,检验氯气的方法是用湿润的淀粉碘化钾试纸,观察是否变蓝;
(4) 转移电子相等,有关系式: N2H4 ~ 2Cu
32128
m3.2g
则m=![]() =0.8g;
=0.8g;
(5) 流程⑤中阳极上铝失电子和水反应生成氧化铝和氢离子,电极反应式为2Al+3H2O-6e-=Al2O3+6H+;
(6)铝失电子生成铝离子进入溶液,废电解液中含有铝离子,铝离子和碳酸氢根离子发生双水解反应生成氢氧化铝沉淀,离子方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】a mol H2和b mol C2H2在密闭容器中反应,当其达到平衡时,生成c mol C2H4,将平衡混合气体完全燃烧生成CO2和H2O,所需氧气的物质的量为
A. (![]() )mol B. (a+3b)mol
)mol B. (a+3b)mol
C. (![]() )mol D. (a+3b+2c)mol
)mol D. (a+3b+2c)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是重要的有机物,可由E和F在一定条件下合成:
已知以下信息: i.A属于芳香烃,H属于酯类化合物。
ii.I的核磁共振氢谱为二组峰,且峰的面积比为6:1。
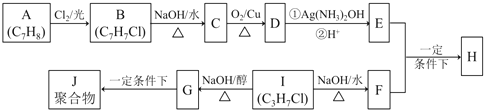
回答下列问题:
(1)E的官能团名称______________,B的结构简式_____________。
(2)B → C和G → J两步的反应类型 _______________,________________。
(3)① E + F → H的化学方程式_____________________。
② I → G 的化学方程式______________________。
(4)I的同系物K比I相对分子质量大28,K有多种同分异构体。
①K的同分异构体共_________________种。
②若K不能发生消去反应,则K的结构简式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液流电池是一种新型可充电的高性能蓄电池,其工作原理如下图。两边电解液存储罐盛放的电解液分别是含有V3+、V2+的混合液和VO2+、VO2+酸性混合液,且两极电解液分开,各自循环。下列说法不正确的是( )

A.充电时阴极的电极反应是V3++e-=V2+
B.放电时,VO2+作氧化剂,在正极被还原,V2+做还原剂,在负极被氧化
C.若离子交换膜为质子交换膜,充电时当有1mol e-发生转移时,左槽电解液的H+的物质的量增加了1mol
D.若离子交换膜为阴离子交换膜,放电时阴离子由左罐移向右罐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(如图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,已知0-t1时,原电池的负极是Al片,反应过程中有红棕色气体产生。下列说法不正确的是

A. 0-t1时,正极的电极反应式为:2H++ NO3- - e-=NO2+ H2O
B. 0-t1时,溶液中的H+ 向Cu电极移动
C. t1时,负极的电极反应式为:Cu–2e-= Cu2+
D. t1时,原电池中电子流动方向发生改变是因为Al在浓硝酸中钝化,氧化膜阻碍了Al的进一步反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0,在一定温度和压强下于密闭容器中,反应达到平衡时,下列叙述正确的是
CO2(g)+H2(g) ΔH<0,在一定温度和压强下于密闭容器中,反应达到平衡时,下列叙述正确的是
A. 升高温度,K增大B. 减小压强,n(CO2)增大
C. 充入一定量的氮气,n(H2)不变D. 更换高效催化剂,CO的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,水作为还原剂的是( )
A.2F2 + 2H2O = 4HF + O2B.Na2O + H2O = NaOH
C.Br2 + H2O ![]() HBr + HBrOD.2Na + 2H2O = 2NaOH + H2↑
HBr + HBrOD.2Na + 2H2O = 2NaOH + H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计的微型实验装置验证SO2的性质,通过分析实验,下列结论表达正确的是

A. a棉球褪色,验证SO2具有氧化性
B. b棉球褪色,验证SO2具有酸性氧化物的通性
C. c棉球蓝色褪去,验证SO2漂白性
D. 可以使用浓硫酸吸收尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g)![]() 2NH3(g)(正反应为放热反应),673K、30MPa下,n(NH3)和n(H2)随时间 t变化的关系如图所示。下列叙述中,正确的是( )
2NH3(g)(正反应为放热反应),673K、30MPa下,n(NH3)和n(H2)随时间 t变化的关系如图所示。下列叙述中,正确的是( )
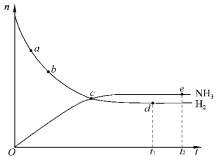
A. 点a的正反应速率比点b的小
B. 点c处正反应速率和逆反应速率相等
C. 点d (t1时刻) 和点 e (t2时刻) 处n(N2)相同
D. 在t2时刻,正反应速率大于逆反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com