
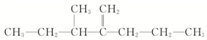 .
. 名称为1-甲基-3-乙基苯.
名称为1-甲基-3-乙基苯.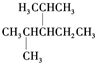 名称为2,4-二甲基-3-乙基戊烷.
名称为2,4-二甲基-3-乙基戊烷.分析 判断有机物的命名是否正确或对有机物进行命名,其核心是准确理解命名规范:
(1)烷烃命名原则:
①长--选最长碳链为主链;
②多--遇等长碳链时,支链最多为主链;
③近--离支链最近一端编号;
④小--支链编号之和最小.看下面结构简式,从右端或左端看,均符合“近-----离支链最近一端编号”的原则;
⑤简--两取代基距离主链两端等距离时,从简单取代基开始编号.如取代基不同,就把简单的写在前面,复杂的写在后面.
(2)有机物的名称书写要规范;
(3)含有官能团的有机物命名时,要选含官能团的最长碳链作为主链,官能团的位次最小.
解答 解:(1)3-甲基-2-丙基-1-戊烯是烯烃,主链有5个碳原子,结构简式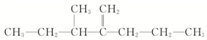 ,
,
故答案为: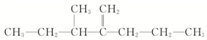 ;
;
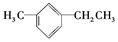
(2)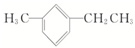 在苯环上有2个取代基甲基和乙基,名称为1-甲基-3-乙基苯,
在苯环上有2个取代基甲基和乙基,名称为1-甲基-3-乙基苯,
故答案为:1-甲基-3-乙基苯;
(3)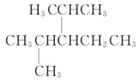 是烷烃选取最长碳原子的为主链,主链含有5个,从离甲基最近的一端编号,名称为:2,4-二甲基-3-乙基戊烷,
是烷烃选取最长碳原子的为主链,主链含有5个,从离甲基最近的一端编号,名称为:2,4-二甲基-3-乙基戊烷,
故答案为:2,4-二甲基-3-乙基戊烷;
(4)CH2=CHCH=CH2CH3有2个双键,双键的位次最小,从左边编号,名称为1,3-戊二烯,
故答案为:1,3-戊二烯;
(5)根据名称2,2,3,3-四甲基戊烷可知,主链上有5个碳原子,在2号和3号碳原子上均各有两个甲基,故结构简式为:(CH3)3CC(CH3)2CH2CH3,
故答案为:(CH3)3CC(CH3)2CH2CH3;
点评 本题考查了有机物的命名,题目难度中等,一般了解烷烃的命名、苯的同系物的命名及简单的烃的衍生物的命名.


科目:高中化学 来源: 题型:选择题
| A. | 酸雨、温室效应、光化学烟雾 | B. | 酸雨、臭氧层空洞、光化学烟雾 | ||
| C. | 水华、臭氧层空洞、光化学烟雾 | D. | 酸雨、臭氧层空洞、白色污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤⑦⑨ | B. | ①④⑤⑥⑩ | C. | ①③④⑤⑦⑧⑨⑩ | D. | ①④⑤⑨⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
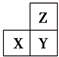
| A. | 若它们均为金属元素,则X、Y与氧元素组成的物质一定是碱性氧化物 | |
| B. | 若它们的原子最外层电子数之和为11,则它们均为非金属元素 | |
| C. | 若它们均不是金属元素,则非金属性:Z>Y>X | |
| D. | Z元素的最高化合价不一定高于X元素的最高化合价 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
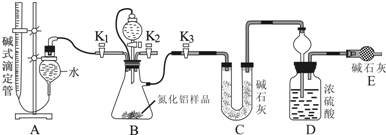
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
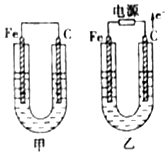 甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:
甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将0.1 mol CO2通入足量NaOH溶液,则溶液中阴离子数目为0.1 NA | |
| B. | 标准状况下,将11.2 L的Cl2通入足量的NaOH溶液中,转移的电子数为NA | |
| C. | 0.1 mol N2与足量H2反应,转移的电子数为0.6 NA | |
| D. | 4.6g由NO2和N2O4组成的混合物中含有氧原子的数目为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| H2(mol/L) | Cl2(mol/L) | V(mol/L•S) |
| 1.0 | 1.0 | 1.0k |
| 2.0 | 1.0 | 2.0k |
| 2.0 | 4.0 | 4.0k |
| A. | m=1,n=2 | B. | m=$\frac{1}{2}$、n=$\frac{1}{2}$ | C. | m=1,n=$\frac{1}{2}$ | D. | m=$\frac{1}{2}$,n=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
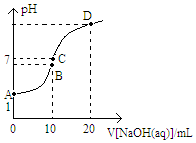 常温下,用0.1mol/LNaOH溶液滴定10mL0.1mol/LH2X溶液,溶液的pH与NaOH溶液的体积关系如图所示,下列说法不正确的是( )
常温下,用0.1mol/LNaOH溶液滴定10mL0.1mol/LH2X溶液,溶液的pH与NaOH溶液的体积关系如图所示,下列说法不正确的是( )| A. | 水电离出来的c(OH-):D点>B点 | |
| B. | C点存在关系式:c(Na+)=c(HX-)+c(X2-)-c(H+) | |
| C. | B点:c(HX-)>c(H+)>c(X2-)>c(H2X) | |
| D. | A点溶液中加入少量水:$\frac{c(O{H}^{-})}{c({H}_{2}X)}$增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com