
【题目】铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。请回答下列问题:
(1)铁元素基态原子的电子排布式为_________,3d能级上的未成对电子数为_________,能量最高能级的电子云形状为_________。
(2)Fe3+可用KSCN溶液检验,形成的配合物颜色为_________,写出一个与SCN-具有相同空间构型的分子:_________。
(3)氮元素的最简单氢化物为氨,氨的沸点_________(填“高于”或“低于”)膦(PH3),原因是_________。氮元素另一种氢化物联氨(N2H4)是_________(填“极性”或“非极性”)分子,其中心原子的轨道杂化类型为_________。
(4)铁的第三电离能(I3),第四电离能(I4)分别为2957kJ/mol,5290kJ/mol,I4远大于I3的原因是_________。
(5)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式:_________。若两个最近的Fe原子间的距离为a cm,则该晶体的密度是_________g/cm3(设阿伏加德罗常数的值为NA)。

【答案】[Ar]3d64s2 4 花瓣形 红色 CO2或CS2 高于 NH3分子间存在氢键,导致沸点高于PH3 极性 sp3 Fe3+的3d能级半充满,结构稳定 8Fe+3NH3![]() 2Fe4N+3H2
2Fe4N+3H2 ![]()
【解析】
(1)铁元素为26号元素,位于第四周期第Ⅷ族,其基态原子的电子排布式为1s22s22p63s23p63d64s2或[Ar]3d64s2;d能级有5个原子轨道,按照洪特规则和泡利原理,因此铁元素的3d能级上未成对电子数为4;按照构造原理,能量最高能级为3d,其电子云形状为花瓣形;
(2)Fe3+与SCN-形成配合物,其配合物的颜色为(血)红色;利用等电子体具有相似化学结构和化学键特征,SCN-与CO2互为等电子体,即SCN-的空间构型为直线型,与之相似的还有CS2等;
(3)氨分子间能形成分子间氢键,其沸点高于不含分子间氢键的PH3;N2H4的结构式为 ,肼分子含有极性键和非极性键,每个氮原子都与相邻的原子形成变形的三角锥形,氮氮单键可以旋转,不一定是对称结构,因此肼为极性分子;N有三个σ键,一个孤电子对,因此杂化类型为sp3;
,肼分子含有极性键和非极性键,每个氮原子都与相邻的原子形成变形的三角锥形,氮氮单键可以旋转,不一定是对称结构,因此肼为极性分子;N有三个σ键,一个孤电子对,因此杂化类型为sp3;
(4)Fe失去3个电子后,Fe3+电子排布式为[Ar]3d5,d能级处于半满,能量低,处于稳定;
(5)根据晶胞的结构,Fe位于顶点和面心,个数为8×1/8+6×1/2=4,N位于晶胞内部,该晶胞的化学式为Fe4N,铁和NH3在640℃可发生置换反应,反应方程式为8Fe+3NH3![]() 2Fe4N+3H2,根据晶胞的结构,两个最近的Fe原子间的距离是面对角线的一半,即晶胞的边长为
2Fe4N+3H2,根据晶胞的结构,两个最近的Fe原子间的距离是面对角线的一半,即晶胞的边长为![]() acm,晶胞的质量为1×(56×4+14)/NAg,根据密度定义,得出该晶胞的密度为
acm,晶胞的质量为1×(56×4+14)/NAg,根据密度定义,得出该晶胞的密度为![]() g/cm3。
g/cm3。


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
【题目】上海某一超市销售的某种食用精制盐包装袋上有如下说明:

(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式并画出电子转移的方向与数目:_____KIO3+_____KI+_____H2SO4=_____K2SO4+_____I2+_____H2O;电子转移情况如下(双线桥表示)__________________________________;
(2)上述反应生成的I2可用叫氯化碳萃取,并用分液漏斗分离出两种溶液。其实验操作可分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50mL碘水和15mL CCL4加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞上的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗方正;
E.旋开活塞,用烧杯接收溶液;
F.从分液漏斗的上口倒出上层水溶液;
G.静置,分层。
a、正确的操作顺序是(用编号字母填写)_____→_____→_____→A→_____→_____E→F。
b、下列物质。还能用作从溶液中萃取碘的溶剂是_____。
A.苯 B.碘化钾 C.酒精
(3)若向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。Na2SO3稀溶液与I2反应的主要产物(化学式)是_____。
(4)已知:I2+2Na2S2O3=2NaI+Na2S4O6.某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L的Na2S2O3溶液15.00mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是_____。
②根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)_____mg/kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中有许多重要用途。回答下列问题:
(1)NH3的沸点比PH3高,原因是________________________________________________。
(2)Na3AsO4 中含有的化学键类型包括________________________;AsO43-的空间构型为____________(用文字描述)。
(3)NH3和F2在Cu催化下可发生反应4NH3+3F2=NF3+3NH4F,化学方程式中的5种物质所属的晶体类型有_____________________(填序号)。写出基态铜原子的价电子排布式_______________。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个不导热的恒容密闭容器中通入CO(g)和H2O(g),一定条件下使反应CO(g)+H2O(g)![]() CO2(g)+H2(g)达到平衡状态,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是
CO2(g)+H2(g)达到平衡状态,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是
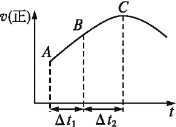
A.反应物浓度:A点小于C点
B.该反应的正反应为吸热反应
C.C点时反应进行的程度最大
D.Δt1=Δt2时,生成H2的物质的量:AB段小于BC段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以方潜矿(PbS)为原料制备铅蓄电池的电极材料的工艺流程如图所示:

部分化合物的Ksp如下表所示:
物质 | PbCl2 | PbS | PbCrO4 |
Ksp | 1.2×10-5 | 9.0×10-29 | 1.8×10-14 |
请回答下列问题:
(1)“焙烧”生成的气体可用于工业制备____________。
(2)写出“高温还原”的主要化学方程式:____________。
(3)“粗铅”的杂质主要有锌,铁,铜,银等,电解精炼时阴极反应式为____________。阳极泥的主要成分为____________。
(4)铅与稀盐酸反应产生少量气泡后反应终止,原因是____________。写出制备PbO2的离子方程式:____________。
(5)Pb(NO3)2是强酸弱碱盐,氢硫酸(H2S)是弱酸,向Pb(NO3)2溶液中通入H2S气体是否能产生黑色PbS沉淀____________?(列式计算说明,Ka1(H2S)=1.3×10-7,Ka2(H2S)=7.1×10-15)。
(6)将PbCrO4加入足量硝酸中,部分振荡,观察到主要现象是____________,反应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为工业合成氨的流程图。有关说法错误的是

A. 步骤①中“净化”可以防止催化剂中毒
B. 步骤②中“加压”既可以提高原料的转化率,又可以加快反应速率
C. 步骤③、④、⑤均有利于提高原料的转化率
D. 产品液氨除可生产化肥外,还可用作制冷剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在化肥、医药、炸药、材料等领域中有着极其重要用途。
(1)羟氨能与溴化银悬浊液反应:2NH2OH+2AgBr=N2↑+2Ag+2HBr+2H2O,羟氨的电子式为________;反应中烃氨表现________性.
(2)已知:a.N2(g)+3H2(g)=2NH3(g) △H=-92.2kJ/mol
b.H2(g)+Cl2(g)=2HCl(g) △H=-184.6kJ/mol
c.2NH3(g)+3Cl2(g)=N2(g)+6HCl(g) △H3
①△H3________.
②反应c在常温下能快速进行的原因为________.
(3)容积均为1L的甲、乙两个容器,其中甲为绝热容器,乙为恒温容器.相同温度下,分别充入0.2mol的NO2,发生反应:2NO2(g)≒N2O4(g) △H<0,甲中NO2的相关量随时间变化如下图所示。
①0~3S内,甲容器中NO2的反应速率增大的原因是________.
②甲达平衡时,温度若为T℃,此温度下的平衡常数Kc=________.
③平衡时,K甲________K乙(填“>”、“<”或“=”,下同),P甲________P乙
(4)化学工作者对NO与H2的反应进行研究,提出下列3步机理:(k为速率常数)
第一步2NO=N2O2 快反应,平衡时:V正=K正·c2(NO)=V逆=K逆·c(N2O2)
第二步N2O2+H2==N2O+H2O 慢反应 第三步N2O+H2=N2+H2O 快反应
其中可近似认为第二步反应不影响第一步平衡,下列说法正确的是________.(填字母标号)
A.V(第一步逆反应)<V(第二步反应) B.总反应快慢主要由第二步反应决定
C.达平衡时,2c(NO)=c(N2O2) D.第一步反应的平衡常数K= K正/ K逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应8NH3+3Cl2=6NH4Cl+N2,回答下列问题:
⑴该反应中氧化剂是______________,被氧化的是________元素。
⑵该反应中参加氧化还原的氧化剂与还原剂的物质的量之比为_____________
⑶用双线桥法标出电子转移的方向与数目_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com