
| m | n | ||
| x | y |
 ,(mn)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为2NaOH+(CN)2=NaCN+NaOCN+H2O.
,(mn)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为2NaOH+(CN)2=NaCN+NaOCN+H2O.分析 (1)(2)4种元素都是短周期元素,且为相邻主族,根据元素在周期表中的位置知,m和n位于第二周期、x和y位于第三周期,x原子核外电子数是m的2倍,y的氧化物具有两性,则y是Al元素,根据元素相对位置可知,x是Mg元素、m是C元素、n元素N元素,据此结合元素周期律知识进行解答.
(3)由4Au+8NaCN+2H2O+O2═4Na[Au(CN)2]+4NaH可知,Au元素的化合价升高,O元素的化合价降低;
(4)氰化钠中毒,可用Na2S2O3缓解,二者反应得到两种含硫元素的离子,其中一种遇到Fe3+可变为血红色,即反应生成SCN-、SO32-,据此书写离子方程式.
解答 解:4元素都是短周期元素,且为相邻主族,根据元素在周期表中的位置知,m和n位于第二周期、x和y位于第三周期,x原子核外电子数是m的2倍,y的氧化物具有两性,则y是Al元素,根据元素位置知,x是Mg元素、m是C元素、n元素N元素,
(1)元素x是Mg元素,其原子序数为12,在周期表中的位置是第三周期第IIA族,制备镁可以用电解熔融氯化镁的方法;
故答案为:第三周期第ⅡA族;MgCl2;
(2)气体分子(mn)2为(CN)2,电子式为 ,根据氯气和氢氧化钠溶液反应知,(CN)2和NaOH反应生成NaCN、NaOCN、H2O,反应方程式为2NaOH+(CN)2=NaCN+NaOCN+H2O,
,根据氯气和氢氧化钠溶液反应知,(CN)2和NaOH反应生成NaCN、NaOCN、H2O,反应方程式为2NaOH+(CN)2=NaCN+NaOCN+H2O,
故答案为: ;2NaOH+(CN)2=NaCN+NaOCN+H2O;
;2NaOH+(CN)2=NaCN+NaOCN+H2O;
(3)由4Au+8NaCN+2H2O+O2═4Na[Au(CN)2]+4NaH可知,Au元素的化合价升高,O元素的化合价降低,则正极反应为O2+2H2O+4e-═4OH-,负极反应为Au+2CN--e-═[Au(CN)2]-,
故答案为:O2+2H2O+4e-═4OH-;Au+2CN--e-═[Au(CN)2]-;
(4)氰化钠中毒,可用Na2S2O3缓解,二者反应得到两种含硫元素的离子,其中一种遇到Fe3+可变为血红色,即反应生成SCN-、SO32-,反应的离子方程式:S2O32-+CN-═SCN-+SO32-;
故答案为:S2O32-+CN-═SCN-+SO32-.
点评 本题考查了元素周期表和元素周期律的综合应用,涉及化学用语的使用、氧化还原反应方程式的书写、电极反应等,题目难度中等,根据元素在周期表中物质及元素性质确定元素,再结合物质的性质即可解答.


科目:高中化学 来源: 题型:选择题
| A. | 23gNa与氧气充分燃烧,转移的电子数为NA | |
| B. | 1mol甲醇中含有的共价键数为4NA | |
| C. | 46gNO2和N2O4的混合气体含有的原子数为2NA | |
| D. | 标准状况下,22.4L氨水含有NH3分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
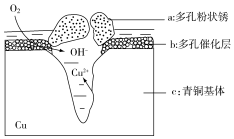 青铜器的制造是中华民族劳动人民智慧的结晶,成为一个时代的象征,但出土的青铜器大多受到环境腐蚀.如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2(OH)3Cl.下列说法不正确的是( )
青铜器的制造是中华民族劳动人民智慧的结晶,成为一个时代的象征,但出土的青铜器大多受到环境腐蚀.如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2(OH)3Cl.下列说法不正确的是( )| A. | 腐蚀过程中,负极c被氧化 | |
| B. | 环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为2Cu2++3OH-+Cl-═Cu2(OH)3Cl↓ | |
| C. | 若生成 2.145 g Cu2(OH)3Cl,则理论上消耗标准状况氧气体积为 0.448 L | |
| D. | 正极的电极反应式为:O2+4e-+2H2O═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
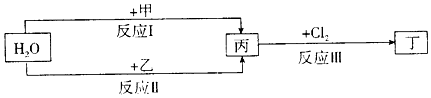
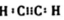 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
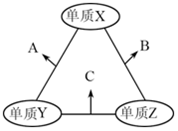 X、Y、Z是原子序数依次增大的三种短周期元素,三种元素的原子序数之和为35,且Z的原子序数是X的原子序数的2倍.X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,下列说法不正确的是( )
X、Y、Z是原子序数依次增大的三种短周期元素,三种元素的原子序数之和为35,且Z的原子序数是X的原子序数的2倍.X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,下列说法不正确的是( )| A. | 元素X,Z的单质均存在同素异形体 | B. | A和C溶于水,溶液均显碱性 | ||
| C. | A和B都可能具有漂白性 | D. | Z的氧化物的水化物一定是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将Cl2通入氢氧化钠溶液制取消毒液:C12+2OH-═Cl-+ClO-+H2O | |
| B. | 己知亚硫酸(H2SO3)的二级电离常数K2比偏铝酸(HAlO2)的电离常数K要大,则将少量的SO2气体通入到偏铝酸钠溶液中发生的离子反应是:2AlO2-+SO2+3 H2O═2 Al(OH)3↓+SO32- | |
| C. | 在明矾溶液中加入氢氧化钡溶液至沉淀的质量达到最大时发生的离子反应是:2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2 Al(OH)3↓ | |
| D. | 利用酸性高锰酸钾测居室中甲醛含量反应为:4MnO4-+5HCHO+12H+═4Mn2++5CO2↑+11H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
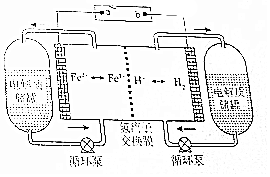 H2-Fe3+/Fe2+氧化还原液流电池是一种新型氧化还原液流电池,电池的结构如图所示,电解质溶液为1 mol/L H2SO4和0.5 mol/L Fe2(SO4)3的混合液.下列说法正确的是( )
H2-Fe3+/Fe2+氧化还原液流电池是一种新型氧化还原液流电池,电池的结构如图所示,电解质溶液为1 mol/L H2SO4和0.5 mol/L Fe2(SO4)3的混合液.下列说法正确的是( )| A. | 充电时,a连接直流电源的正极 | |
| B. | 充电时,阴极的电极反应式为2Fe3++2e-═2Fe2+ | |
| C. | 放电时,右侧电解质储罐中的SO42-浓度逐渐增加 | |
| D. | 放电时,当转移0.1mol e-时,透过交换膜的离子有0.2mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com