


 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:
 一定条件下存在反应:2SO2(g)+O2(g)?2SO3(g),其正反应放热.图1、图2表示起始时容器甲、丙体积都V,容器乙、丁体积都是
一定条件下存在反应:2SO2(g)+O2(g)?2SO3(g),其正反应放热.图1、图2表示起始时容器甲、丙体积都V,容器乙、丁体积都是| V |
| 2 |
| A、图1达平衡时,浓度c(SO2):甲=乙 |
| B、图1达平衡时,平衡常数K:甲>乙 |
| C、图2达平衡时,所需时间t:丙<丁 |
| D、图2达平衡时,体积分数φ(SO3):丙>丁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
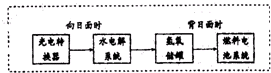 “神七”登天标志着我国的航天事业进入了新的篇章.
“神七”登天标志着我国的航天事业进入了新的篇章.查看答案和解析>>
科目:高中化学 来源: 题型:
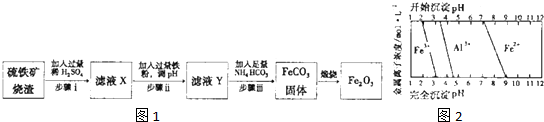
| 微粒平衡 | 平衡常数 | ||||
Fe3CO3(s)?Fe2+(aq)+CO
| Ksp=3.2×10-11 | ||||
H2CO3?H++HCO
| Ka1=4.36×10-7 | ||||
HCO
| Ka2=4.68×10-11 | ||||
2HCO
| K=1.3×-4 |
- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| >1000K |
| x |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
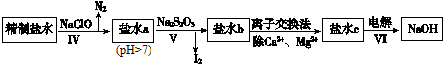
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com