
3、在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是
A.Na+、K+、SiO32-、Cl- B.Na+、Cu2+ 、SO42-、NO3-
C.Mg2+、Na+、SO42-、Cl- D.Ba2+、HCO3-、ClO-、K+
科目:高中化学 来源:2014-2015四川省绵阳市高一上学期期末化学试卷(解析版) 题型:选择题
关于反应2Na2O2+2CO2==2Na2CO3+O2 的下列说法正确的是
A.CO2是还原剂,在该反应中被氧化
B.Na2O2是氧化剂,在该反应中发生氧化反应
C.氧化剂和还原剂的物质的量之比为1∶2
D.若有2 mol Na2O2参加反应,则有2 mol电子转移
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市西城区高三上学期期末考试化学试卷(解析版) 题型:选择题
11.能正确表示下列反应的离子方程式是
A.铝放入烧碱溶液中溶解:Al+2OH- = AlO2- +H2↑
B.碳酸钙溶于醋酸溶液:CaCO3+2H+ = Ca2++CO2↑+H2O
C.稀硫酸中加氢氧化钡溶液至中性:H+ + OH- = H2O
D.氯化铁溶液呈酸性:Fe3+ + 3H2O 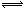 Fe(OH)3 +3H+
Fe(OH)3 +3H+
查看答案和解析>>
科目:高中化学 来源:2015-2015湖南省高二12月学科联赛化学试卷(解析版) 题型:选择题
15.反应A(g)+3B(g) 2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
A.υ(C)=0.4 mol / (L·s) B.υ(B)=0.45 mol / (L·s)
C.υ(A)=0.15 mol / (L·s) D.υ(D)=0.35 mol / (L·s)
查看答案和解析>>
科目:高中化学 来源:2015-2015湖南省高二12月学科联赛化学试卷(解析版) 题型:选择题
8.某兴趣小组设计如图所示的微型实验装置。实验时,现断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述正确的是
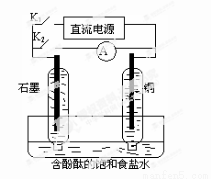
A.断开K2,闭合K1时,总反应的离子方程式为:2H+ + 2Cl-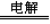 Cl2↑+H2↑
Cl2↑+H2↑
B.断开K2,闭合K1时,石墨电极附近溶液变红
C.断开K1,闭合K2时,铜电极上的电极反应为: Cl2+2e-=2Cl-
D.断开K1,闭合K2时,石墨电极作正极
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高二上学期第二次统练化学试卷(解析版) 题型:填空题
25.(12分)发展储氢技术是氢氧燃料电池推广应用的关键。研究表明液氨是一种良好的储氢物质,其储氢容量可达17.6% (质量分数)。液氨气化后分解产生的氢气可作为燃料供给氢氧燃料电池。氨气分解反应的热化学方程式如下:
2NH3(g) 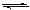 N2 (g) + 3H2(g) ΔH = +92.4 kJ·mol-1
N2 (g) + 3H2(g) ΔH = +92.4 kJ·mol-1
请回答下列问题:
(1) 氨气自发分解的反应条件是 。(填“高温”、“低温”或“任何条件下”)
(2) 已知:2H2(g)+O2(g)=2H2O(g) ΔH = - 483.6 kJ·mol-1
NH3(l)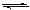 NH3(g) ΔH = +23.4 kJ·mol-1
NH3(g) ΔH = +23.4 kJ·mol-1
则,反应4NH3(l)+3O2(g)=2N2(g)+6H2O(g)的ΔH = 。
(3) 研究表明金属催化剂可加速氨气的分解。图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率。
①不同催化剂存在下,氨气分解反应的活化能最大的是 (填写催化剂的化学式)。
②恒温(T1)恒容时,用Ni催化分解初始浓度为c0的氨气,并实时监测分解过程中氨气的浓度。计算后得氨气的转化率α(NH3)随时间t变化的关系曲线(见图2)。请在图2中画出:在温度为T1,Ru催化分解初始浓度为c0的氨气过程中α(NH3) 随t变化的总趋势曲线(标注Ru-T1)。
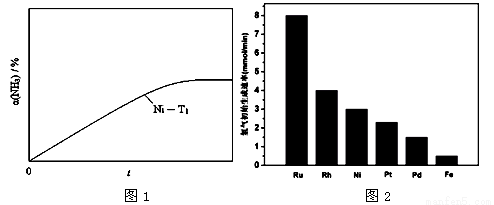
③如果将反应温度提高到T2,请在图2中再添加一条Ru催化分解初始浓度为c0的氨气过程中α(NH3) ~ t的总趋势曲线(标注Ru-T2)
(4) 用Pt电极对液氨进行电解也可产生H2和N2。阴极的电极反应式是 。
(已知:液氨中2NH3(l) 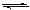 NH2- + NH4+)
NH2- + NH4+)
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高二上学期第二次统练化学试卷(解析版) 题型:选择题
18.下列各溶液中,相关微粒物质的量浓度关系不正确的是
A.0.1 mol·L-1NH3?H2O溶液中: c (NH4+)<c (OH-)
B.常温时,将等体积的盐酸和氨水混合后pH=7,则c(NH4+)=c(Cl-)
C.0.1 mol·L-1Na2CO3溶液中:c(HCO3-)+c(CO3-)+c(H2CO3)=0.1 mol·L-1
D.浓度均为0.1 mol·L-1的NH4Cl、CH3COONH4、NH4HSO4溶液,c(NH4+)大小顺序:CH3COONH4 >NH4Cl>NH4HSO4
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高二上学期第二次统练化学试卷(解析版) 题型:选择题
1.2014年6月5日为世界环境日,主题为“提高你的呼声而不是海平面”,提倡节能减排,以下措施中不能体现这一思想的是
A.在电解铝工业中添加冰晶石
B.研制出性能优良的催化剂,降低反应所需温度
C.开发太阳能、风能、氢能等清洁能源
D.大力发展火电,缓解用电紧张
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省文登市高一上学期期末考试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.0.1 mol·L-1 Na2S溶液中含有0.2 NA个Na+
B.标准状况下,22.4 L 的H2O含有2NA个氢原子
C.常温下,44 g CO2含有NA个氧原子
D.0.1 mol Na与足量O2反应生成Na2O,转移0.1 NA个电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com