
| A. | 钠跟水的反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 次氯酸钙溶液中通入过量CO2:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| C. | 碳酸氢钙溶液加入过量的氢氧化钠溶液:HCO3-+OH-═CO32-+H2O | |
| D. | 碳酸氢钠溶液中加入盐酸:HCO3-+H+═CO2↑+H2O |
分析 A.钠与水反应生成氢氧化钠和氢气,该反应为置换反应;
B.二氧化碳过量,反应生成碳酸氢钙;
C.氢氧化钠过量,反应生成碳酸钙沉淀和碳酸钠;
D.碳酸氢钠与盐酸反应生成氯化钠、二氧化碳气体和水.
解答 解:A.钠跟水的反应为:2Na+2H2O═2Na++2OH-+H2↑,该反应为置换反应,不属于复分解反应,故A错误;
B.次氯酸钙溶液中通入过量CO2,反应不会生成碳酸钙沉淀,正确的离子方程式为:ClO-+CO2+H2O=HCO3-+HC1O,故B错误;
C.碳酸氢钙与过量的NaOH溶液反应时,钙离子和碳酸氢根按物质的量之比为1:2进行反应,正确离子方程式为:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-,故C错误;
D.碳酸氢钠溶液中加入盐酸,反应生成二氧化碳气体和水,反应的离子方程式为:HCO3-+H+═CO2↑+H2O,故D正确;
故选D.
点评 本题考查了离子方程式的判断,题目难度中等,注意明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
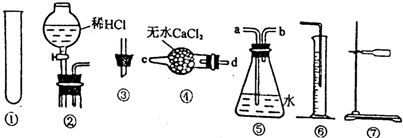
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
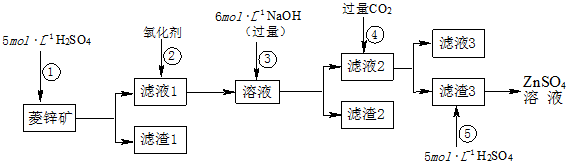
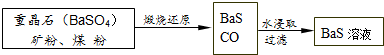
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠溶液跟少量的饱和石灰水反应2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O | |
| B. | 向氢氧化钠溶液中加入稀醋酸 OH-+H+═H2O | |
| C. | 向氯化铁溶液中加入铁粉 Fe+FeCl3=2Fe2++3Cl- | |
| D. | Ca(ClO)2溶液中通入过量的二氧化硫气体Ca2++2ClO-+H2O+SO2═CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去K2CO3固体中少量NaHCO3:置于坩埚中加热 | |
| B. | 除去苯中溶有的少量苯酚:加入适量浓溴水反应后过滤 | |
| C. | 除去FeC13 酸性溶液中少量的FeC12:加入稍过量双氧水后放置 | |
| D. | 除去蛋白质溶液中混入的少量氯化钠:加AgNO3溶液后过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用10mL量筒量取稀硫酸溶液 8.0mL | |
| B. | 用干燥的pH试纸测定氯水的pH | |
| C. | 用碱式滴定管量取KMnO4溶液 19.60mL | |
| D. | 使用容量瓶配制溶液时,俯视液面定容后所得溶液的浓度偏大 | |
| E. | 圆底烧瓶、锥形瓶、蒸发皿加热时都应垫在石棉网上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验内容 | 结论 |
| A | 一红棕色气体能使湿润的KI-淀粉试纸变蓝 | 证明该红棕色气体一定为溴蒸气 |
| B | 向某溶液中加入氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| C | 铝箔在酒精灯火焰上加热熔化但不滴落 | 说明铝箔表面氧化铝膜熔点高于铝 |
| D | 取少量待测晶体于试管中,加浓的NaOH溶液并加热,试管口湿润的红色石蕊试纸变蓝 | 证明晶体成分中含有NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 利用了03的强氧化性杀菌 | |
| B. | 所用03是从高空臭氧层采取的,来源丰富 | |
| C. | 03消毒可以避免液氯消毒有氯代烃生成的缺点,更符合卫生要求 | |
| D. | O3消毒的自来水没有气味,消毒过程中也不生成污染物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com