
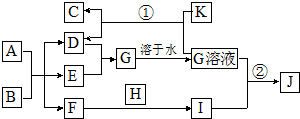
 在如图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,K是黑色固体,D和F反应可用于工业上生产漂白液,H可用于制造光导纤维,J是一种乳白色凝胶状沉淀.(部分生成物和反应条件未列出)
在如图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,K是黑色固体,D和F反应可用于工业上生产漂白液,H可用于制造光导纤维,J是一种乳白色凝胶状沉淀.(部分生成物和反应条件未列出)
分析 在如图所示的物质转化关系中,A是海水中含量最丰富的盐,则A为氯化钠,B是常见的无色液体,B为水,氯化钠溶液电解得D、E、F,对应的为氯气、氢气和氢氧化钠,D和F反应可用于工业上生产漂白液,则D、F为氢氧化钠和氯气,所以E为氢气,D、F反应生成G,G溶于水得G溶液,所以D为氯气,G为氯化氢,F为氢氧化钠,H可用于制造光导纤维,则H为二氧化硅,由F和H反应生成I为硅酸钠,I与G生成J,J是一种白色凝胶状沉淀,可知J为硅酸,K是黑色固体,能与盐酸反应生成氯气,所以K为二氧化锰,C为氯化锰,据此答题.
解答 解:在如图所示的物质转化关系中,A是海水中含量 最丰富的盐,则A为氯化钠,B是常见的无色液体,B为水,氯化钠溶液电解得D、E、F,对应的为氯气、氢气和氢氧化钠,D和F反应可用于工业上生产漂白液,则D、F为氢氧化钠和氯气,所以E为氢气,D、F反应生成G,G溶于水得G溶液,所以D为氯气,G为氯化氢,F为氢氧化钠,H可用于制造光导纤维,则H为二氧化硅,由F和H反应生成I为硅酸钠,I与G生成J,J是一种白色凝胶状沉淀,可知J为硅酸,K是黑色固体,能与盐酸反应生成氯气,所以K为二氧化锰,C为氯化锰,
(1)B为水,B的电子式为 ,故答案为:
,故答案为: ;
;
(2)H为二氧化硅,H的化学式为SiO2,故答案为:SiO2;
(3)反应①的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(4)反应②的离子方程式2H++SiO32-=H2SiO3↓,故答案为:2H++SiO32-=H2SiO3↓.
点评 本题考查无机物推断,涉及常见元素单质及其化合物性质,需要学生熟练掌握元素化合物知识,题目难度中等.


 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ③⑤⑥ | C. | ②④⑤ | D. | 全部错误 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中C失去电子,被还原 | |
| B. | 该反应中氢气得到电子,被还原 | |
| C. | 该反应中,每转移2mole-则生成1mol氢气. | |
| D. | 该反应属于复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气和氯气反应生成氯化氢气体是放热反应,所以不需要条件就能自发进行 | |
| B. | 氢气和氯气反应生成2 mol氯化氢气体,反应吸收183 kJ的热量 | |
| C. | 氢气和氯气反应生成2 mol氯化氢气体,反应放出183 kJ的热量 | |
| D. | 氢气和氯气反应生成1 mol氯化氢气体,反应放出183 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸的结构式:H-Cl-O | B. | CO2的比例模型  | ||
| C. | 甲基的电子式: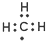 | D. | 硬脂酸的化学式:C17H33COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第三周期第IA族 | B. | 第四周期第IA族 | C. | 第五周期第IA族 | D. | 第二周期第IIA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com