
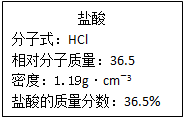
 (1)已知24克A和40克B恰好完全反应生成0.4molC和32克D,则C的摩尔质量为
(1)已知24克A和40克B恰好完全反应生成0.4molC和32克D,则C的摩尔质量为| m |
| n |
| 1000ρw |
| M |
| n |
| V |
| m |
| n |
| 32g |
| 0.4mol |
| 1000ρw |
| M |
| 1000×1.19×36.5% |
| 36.5 |
| 0.5L×1.19mol/L |
| 11.9mol/L |
| n |
| V |
| n |
| V |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题.
如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol?L-1NH4Cl溶液中:c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| B、溶有等物质的量NaClO、NaHCO3的溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
| C、pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-) |
| D、25℃时,pH=7的NH4Cl与NH3?H2O混合溶液:c(H+)=c(OH-)=c(NH4+)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾.
用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾.查看答案和解析>>
科目:高中化学 来源: 题型:
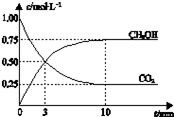 已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.一定条件下,向体积为 1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.下列叙述中,正确的是( )
已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.一定条件下,向体积为 1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.下列叙述中,正确的是( )| A、升高温度能使CH3OH增加 |
| B、反应达到平衡状态时,CO2的平衡转化率为75% |
| C、3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率 |
| D、从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 mol?L-1?min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定含有I-,不能确定是否含有Cl- |
| B、可能含有NO3-、Cl-和I- |
| C、可能含有NO3- |
| D、一定含有Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com