
����Ŀ��CO��CO2�ǻ������糧�ͷų�����Ҫβ����Ϊ���ٶԻ�����ɵ�Ӱ�죬���糧��ͼ�������·���������Դ�����ã����»��ȼ�ϻ���Ҫ��ҵ��Ʒ��
��1��CO��Cl2�ڴ����������ºϳɹ�����COCl2����ij�¶��£���2L���ܱ�������Ͷ��һ������CO��Cl2���ڴ����������·�����Ӧ��CO��g��+Cl2��g��![]() COCl2��g�� ��H =a kJ/mol��Ӧ�����вⶨ�IJ����������±�:
COCl2��g�� ��H =a kJ/mol��Ӧ�����вⶨ�IJ����������±�:

�ٷ�Ӧ0��2minĩ��ƽ������v��COCl2��=_______mol/��L��min����
����2min��4min�䣬v��Cl2����______v��Cl2���� ���>������=����<������ ���¶���K =_______L/ mol��
����֪X��L�ɷֱ�����¶Ȼ�ѹǿ����ͼ��ʾLһ��ʱ��CO��ת������X�ı仯��ϵ��
X��������������__________��a_________0 ���>������=������<������

��2���ڴ���������NO��COת��Ϊ�����壺
2CO��g����2NO��g��![]() 2CO2��g����N2��g�� ��H=��748 kJ��mol-1
2CO2��g����N2��g�� ��H=��748 kJ��mol-1
��һ�������£���λʱ���ڲ�ͬ�¶��²ⶨ��NOת������ͼ1��ʾ���¶ȸ���710Kʱ�����¶ȵ�����NOת���ʽ��͵�ԭ�������____________________��
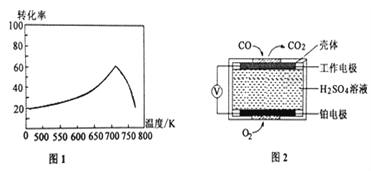
����֪���ⶨ������NO��CO�������õķ��������֣�����1���绯ѧ������������������CO�������Ĺ���ԭ����ͼ2��ʾ�������缫�ķ�ӦʽΪ________________������2��������ԭ�ζ�������H2O2��Һ����β��������������ת��Ϊǿ�ᣬ������к͵ζ����ⶨǿ��Ũ�ȡ�д��NO��H2O2��Һ��Ӧ�����ӷ���ʽ______________________��
��3��һ�������£���CO��H2����2L�ܱ������з�Ӧ�������ɼ���(CH3OCH3)��
4H2(g)��2CO(g)![]() CH3OCH3(g)��H2O(g) ��H��0
CH3OCH3(g)��H2O(g) ��H��0
�������жϷ�Ӧ�ﵽƽ�����_______________��
A����(H2)��2��(CO) B�������ڵ�ѹǿ����
C�����������ܶȲ��� D����������ƽ����Է�����������
E�����ѵ�Ũ�ȱ��ֲ���
���𰸡� 0.1 = 5 �¶� < �¶����ߵ�710Kʱ����Ӧ�ﵽƽ��״̬�����ڸ÷�Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ�������ƶ�����������ת���ʽ��� CO-2e��+H2O��CO2+2H+ 2NO+3H2O2��2NO3��+2H2O+2H+ BDE
����������1�����ɱ������ݣ���֪0��2min����n��CO��=1.2mol-0.8mol=0.4mol���ɷ���ʽ��֪��c��COCl2��=��c��CO��=0.4mol����v��COCl2��=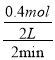 =0.1mol/��L��min������4min�ڣ���Ӧ������Ϊ0.6mol-0.2mol=0.4mol���ɷ���ʽ��֪�μӷ�Ӧ��COΪ0.4mol����4minʱCOΪ1.2mol-0.4mol=0.8mol����2minʱCO�����ʵ�����ȣ���2min��4min����ƽ��״̬����2min��4min�䣬v��Cl2���� =v��Cl2�������ɷ���ʽ��֪��ƽ��ʱ����COCl2Ϊ0.4mol�����¶���ƽ�ⳣ��K=
=0.1mol/��L��min������4min�ڣ���Ӧ������Ϊ0.6mol-0.2mol=0.4mol���ɷ���ʽ��֪�μӷ�Ӧ��COΪ0.4mol����4minʱCOΪ1.2mol-0.4mol=0.8mol����2minʱCO�����ʵ�����ȣ���2min��4min����ƽ��״̬����2min��4min�䣬v��Cl2���� =v��Cl2�������ɷ���ʽ��֪��ƽ��ʱ����COCl2Ϊ0.4mol�����¶���ƽ�ⳣ��K=![]() =
=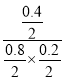 =5��������ӦΪ���������С�ķ�Ӧ������ѹǿƽ�������ƶ���COת��������ͼ����X����ʱ��CO��ƽ��ת���ʽ��ͣ�ƽ�������ƶ�����XΪ�¶ȣ�����ӦΪ���ȷ�Ӧ����a��0����2���ٵ��¶����ߵ�710Kʱ����λʱ���ڷ�Ӧ��ƽ�⣬���ڸ÷�Ӧ�Ƿ��ȷ�Ӧ���������¶ȣ�ƽ�������ƶ���ת���ʽ��ͣ��ڸ�װ����ԭ��أ�ͨ��һ����̼�ĵ缫�Ǹ�����������һ����̼ʧ���ӷ���������Ӧ���缫��ӦʽΪ��CO-2e-+H2O��CO2+2H+��NO��H2O2��Һ������ǿ�����ᣬ˫��ˮ����ԭ��ˮ����Ӧ�����ӷ���ʽ2NO+3H2O2��2NO3-+2H2O+2H+����3��A����(H2)��2��(CO)û��ע����Ӧ���ʵķ���һ������ƽ��״̬��A����B������Ӧ�����С����������ڵ�ѹǿ����˵����Ӧ����ƽ��״̬��B��ȷ��C���ܶ��ǻ�����������������ݻ��ı�ֵ���ڷ�Ӧ�������������ݻ�ʼ���Dz���ģ���˻��������ܶȲ��䲻һ������ƽ��״̬��C����D���������ƽ����Է��������ǻ�����������ͻ�������ܵ����ʵ����ı�ֵ���������䣬�����ʵ����DZ仯�ģ����Ի�������ƽ����Է�����������˵������ƽ��״̬��D��ȷ���ţ����ѵ�Ũ�ȱ��ֲ���˵����Ӧ����ƽ��״̬��E��ȷ����ѡBDE��
=5��������ӦΪ���������С�ķ�Ӧ������ѹǿƽ�������ƶ���COת��������ͼ����X����ʱ��CO��ƽ��ת���ʽ��ͣ�ƽ�������ƶ�����XΪ�¶ȣ�����ӦΪ���ȷ�Ӧ����a��0����2���ٵ��¶����ߵ�710Kʱ����λʱ���ڷ�Ӧ��ƽ�⣬���ڸ÷�Ӧ�Ƿ��ȷ�Ӧ���������¶ȣ�ƽ�������ƶ���ת���ʽ��ͣ��ڸ�װ����ԭ��أ�ͨ��һ����̼�ĵ缫�Ǹ�����������һ����̼ʧ���ӷ���������Ӧ���缫��ӦʽΪ��CO-2e-+H2O��CO2+2H+��NO��H2O2��Һ������ǿ�����ᣬ˫��ˮ����ԭ��ˮ����Ӧ�����ӷ���ʽ2NO+3H2O2��2NO3-+2H2O+2H+����3��A����(H2)��2��(CO)û��ע����Ӧ���ʵķ���һ������ƽ��״̬��A����B������Ӧ�����С����������ڵ�ѹǿ����˵����Ӧ����ƽ��״̬��B��ȷ��C���ܶ��ǻ�����������������ݻ��ı�ֵ���ڷ�Ӧ�������������ݻ�ʼ���Dz���ģ���˻��������ܶȲ��䲻һ������ƽ��״̬��C����D���������ƽ����Է��������ǻ�����������ͻ�������ܵ����ʵ����ı�ֵ���������䣬�����ʵ����DZ仯�ģ����Ի�������ƽ����Է�����������˵������ƽ��״̬��D��ȷ���ţ����ѵ�Ũ�ȱ��ֲ���˵����Ӧ����ƽ��״̬��E��ȷ����ѡBDE��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ε�SiO2��ɣ���������Fe2O3��Al2O3���л�������ʡ���ҵ�ϰ����������ù������Ʊ����������衣

(1)���չ�������Ŀ����__��
(2)�ڼ��������¼����ռ�ʱ��Ӧ�Ļ�ѧ����ʽΪ__��
(3)���������������ɽ���ķ�Ӧ����ʽΪ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��������������MnO2�ͺ���4 mol���ʵ�Ũ�����ַ�Ӧ������������˵����ȷ����(����)
A. ��ʵ���й�����1 mol MnO2������1 mol����
B. Ϊ�˳�ȥ�����л��е��������壬��������ͨ������ʳ��ˮ�ͼ�ʯ��
C. �ڸ÷�Ӧ��MnO2����������Ũ��������ԭ��
D. ���������������ſ���������ˮ���ռ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����п��������������ηɻ��������״ﲨͿ�ϡ����ԷϾ�п�̵��Ϊԭ���Ʊ���п���������Ҫ�������£�

(1)����п�̸ɵ�أ������Ϊ KOH���� MnO2���뷴Ӧ�ĵ缫��ӦʽΪ______________________��
(2)���������ʱ��Ϊ����߽�ȡ�ʿɲ�ȡ�Ĵ�ʩ��________________________����дһ�㣩�����ʱ���������̱�˫��ˮ��ԭ�Ļ�ѧ����ʽΪ___________________��
(3)�������۳���ʱ�����۵�������______________ (��������� ��ԭ���� ���������� �� ��
(4)�������Ե���Ϊ����������Һ������������ KMnO4��Һ�������ն�ʵ�ֵġ� �ڲ�ͬpH�£�KMnO4��Һ��Hg�������ʵ�Ӱ�켰��Ҫ������ͼ��ʾ��

������ݸ�ͼ���� pH�Թ�������Ӱ��ı仯���ɣ� __________________________��
���Է�����ǿ���Ի����� Hg �ĵ�λʱ�������ʸߵ�ԭ������ǣ� _______________��
(5)���ⶨ��Һ�ɷֺ�ͬʱ����һ������ MnSO4�����۵�Ŀ����________________��
(6)�� x��0.2 ʱ�����õ�����п��������״ﲨ�����������ر�ǿ���������������ʽ��ʾ�����������_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ҫ֤��ij��Һ�в��� Fe3+�����ܺ�Fe2+����������ʵ�����ʱ�����˳��Ϊ�� ��
������������ˮ ����������I2ˮ ����������KSCN��Һ��
A.�٢�B.�ۢ�C.�ۢ�D.�٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ���������仯������ʾ��H2(g)��Cl2(g)===2HCl(g) ��H
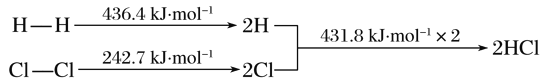
����˵���������( )
A. H��H����Cl��Cl���ȶ�
B. ����Ӧ��ܱ��淴Ӧ��ܸ�
C. ��H����184.5 kJ��mol��1
D. ����ͬ��������1 mol H2(g)��1 mol Cl2(g)�ֱ��ڵ�ȼ���������·�Ӧ����2 mol HCl(g)�����»ָ���ԭ����״̬ʱ��H��ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������м��ַ�Ӧ���ͣ� ����ȥ ��ȡ�� �������ܼӳ� �ݻ�ԭ ��ˮ�⣬�ñ�ȩ��ȡ 1��2�������� ��![]() ��������ȷ�ĺϳ�·�����η����ķ�Ӧ�������Ͳ������ǣ� ��
��������ȷ�ĺϳ�·�����η����ķ�Ӧ�������Ͳ������ǣ� ��
A. �ݢ٢ܢ� B. �ܢ٢ܢ� C. �ݢ٢ܢ� D. �ݢۢޢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ҷ��������(D)����ʯ�����ѽ�õ���ϩ���ϳɡ��ش��������⣺

��1��B��AΪͬϵ��� B �ļӾ۲���Ľṹ��ʽΪ________��
��2����Ӧ�ٵĻ�ѧ����ʽΪ __________________��
��3����Ӧ�۵Ļ�ѧ����ʽΪ__________________����Ӧ����Ϊ__________________��
��4����Ӧ�ڵĻ�ѧ����ʽΪ__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ϡ���������ҹ�ս������Դ����̼�����Ҫ��ѧ�ɷ�ΪCeFCO3��������ȡ����ϡ��Ԫ�ص���Ҫ����ԭ�ϡ�����һ����ȡ��Ĺ����������£�

��֪�����պ������к���4�۵��漰+3�۵�����ϡ���������+ 4�۵�����������к�ǿ�������ԣ�ͨ���������������ױ���ԭ����ԭ�ɣ�3�۶�����ˮ����ش���������
��1�����l�����õ���AΪ������ĸ��ʾ��________��a������ b��ϡ���ᣩ��ԭ����_______��
��2���������Ϊ�������������ķ���������ʽ��ʧ�����ÿ����Լ��ν��ķ���������ӳ�����ȥ���÷�Ӧ�����ӷ���ʽΪ___________��
��3��ʵ�����н�����ȡ�������õ�����Ҫ��������������________���ڲ���I�����Һ�м���NaOH��Һ��Ϊ�˵�����ҺpH ���Ce(OH)3��_______���ⶨ����ҺpH�IJ�����_______��
��4��д����������Ļ�ѧ����ʽ_______________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com