
| A、该温度下,0.31 mol?L HF溶液的pH=2 |
| B、升高温度或增大浓度,HF的电离平衡常数都将增大 |
| C、两溶液混合后不会产生沉淀 |
| D、向饱和的CaF2溶液中加水后,c(Ca2+)一定比加水前减小 |
| Ka×c(F-) |
| 3.3×10-4×0.31 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
| t/min | CO(g)/(mol?L-1) | H2O(g)/(mol?L-1) | CO2(g)/(mol?L-1) | H2(g)/(mol?L-1) |
| 0 | 0.20 | 0.3 | 0 | 0 |
| 3 | 0.08 | 0.18 | c | c |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+一定存在,Cl-可能存在 |
| B、100 mL溶液中含0.01 mol CO32- |
| C、Cl-一定存在,K+可能存在 |
| D、Ba2+一定不存在,Ca2+可能存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化工集团用氨碱法生产的纯碱中含有少量氯化钠杂质.为了测定该产品中碳酸钠的纯度,进行了以下实验:取16.5g纯碱样品放人烧杯中,将烧杯放在电子称上,再把0.0g稀盐酸(足量)加入样品中.观察读数变化如下表所示:
某化工集团用氨碱法生产的纯碱中含有少量氯化钠杂质.为了测定该产品中碳酸钠的纯度,进行了以下实验:取16.5g纯碱样品放人烧杯中,将烧杯放在电子称上,再把0.0g稀盐酸(足量)加入样品中.观察读数变化如下表所示:| 时间/s | 0 | 5 | 10 | 15 |
| 读数/g | 215.2 | 211.4 | 208.6 | 208.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、11.2 L氧气中所含有的原子数为NA |
| B、常温常压下,48gO3含有的氧原子数为3NA |
| C、物质的量浓度为0.5 mol?L-1的MgCl2溶液中,含有Cl-个数为NA |
| D、C.1molMg与足量O2反应转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
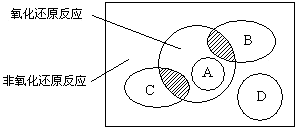 图中方框内区域表示所有的化学反应,大圈内区域表示氧化还原反应,大圈外区域表示非氧化还原反应,其中A~D分别表示四种基本反应类型.请分别填出:
图中方框内区域表示所有的化学反应,大圈内区域表示氧化还原反应,大圈外区域表示非氧化还原反应,其中A~D分别表示四种基本反应类型.请分别填出:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CuSO4+H2S=CuS↓+H2SO4 | ||||
B、Cu2(OH)2CO3
| ||||
| C、2FeCl3+Cu=2FeCl2+CuCl2 | ||||
| D、4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com