
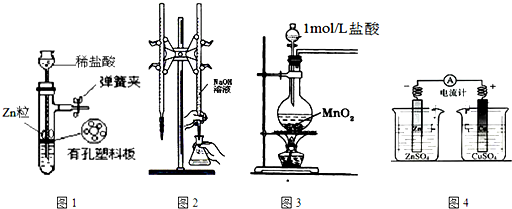
| A. | 用图1所示装置制取少量H2 | |
| B. | 用图2所示装置用标准浓度的氢氧化钠溶液测定盐酸的浓度 | |
| C. | 用图3所示装置制取少量Cl2 | |
| D. | 用图4所示装置确定导线中有电流通过及并确定电流方向 |
分析 A.装置和原理均正确且同时起到随关随停的效果;
B.氢氧化钠溶液应该盛放在碱性滴定管中;
C.二氧化锰和稀盐酸不反应,和浓盐酸反应制取氯气;
D.该装置没有形成闭合回路.
解答 解:A.装置和原理均正确且同时起到随关随停的效果,为简易启普发生器,故A正确;
B.氢氧化钠溶液应盛放在碱式滴定管中,氢氧化钠和二氧化硅反应生成粘性硅酸钠而导致活塞打不开,该滴定管为酸性滴定管,故B错误;
C.稀盐酸与二氧化锰不反应,应该用浓盐酸,故C错误;
D.缺少盐桥,没有形成闭合回路,所以没有电流产生,故D错误;
故选A.
点评 本题考查化学实验方案评价,为高频考点,涉及气体的制取、滴定管的用途、原电池原理等知识点,明确实验原理及实验操作规范性、物质性质是解本题关键,注意从操作规范性及反应原理方面分析解答,易错选项是D.


科目:高中化学 来源: 题型:解答题
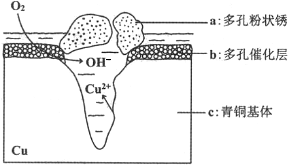
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数由多到少的顺序:Y、X、W、Z | |
| B. | 原子半径由大到小的顺序:W、Z、Y、X | |
| C. | 元素非金属性由强到弱的顺序:Z、W、X | |
| D. | 简单气态氢化物的稳定性由强到弱的顺序:X、Y、W |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
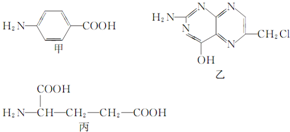 叶酸是维生素B族之一,可以由下列甲、乙、丙三种物质合成.
叶酸是维生素B族之一,可以由下列甲、乙、丙三种物质合成.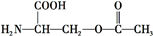 .
.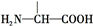
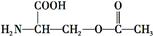 +2NaOH→HOCH2CH(NH2)COONa+H2O+CH3COONa.
+2NaOH→HOCH2CH(NH2)COONa+H2O+CH3COONa.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 |  |  |  |
| ① | ② | ③ | ④ |
| A. | 装置①可用于模拟氯碱工业生产氯气 | |
| B. | 装置②的原理可用于潮汐能发电站钢阀门的保护 | |
| C. | 装置③可用于食盐水的蒸发结晶 | |
| D. | 装置④可用于二氧化锰与浓盐酸反应制取氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M与X的化合物对应的水化物不一定都是强酸 | |
| B. | Y2X和Y2X2中化学键类型相同,阴、阳离子的个数比相同 | |
| C. | 气态氢化物的热稳定性:M<N | |
| D. | 离子半径r:r(X2-)>r(Y+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 17.6 g丙烷中所含的共价键数目为4NA | |
| B. | 常温下,1L pH=13的Ba(OH)2溶液中含有的OH-离子数目为0.2NA | |
| C. | 标准状况下,5.6 L NO和5.6 L O2混合后的分子总数目为0.5NA | |
| D. | 电解精炼铜时,若阳极质量减少64 g,则阴极得到电子的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com