重铬酸盐广泛用作氧化剂、皮革制作等.以铬矿石(主要成分是Cr
2O
3,含FeO、Al
2O
3、SiO
2等杂质)为原料制取重铬酸钠的流程如图1:
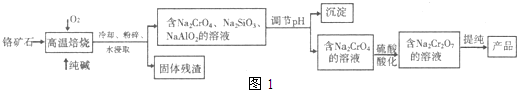
请回答下列问题:
(1)写出Cr
2O
3在高溫焙烧时反应的化学方程式
(2)写出硫酸酸化使Na
2CrO
4转化为Na
2Cr
2O
7的离子方程式
.
(3)某工厂采用石墨电极电解Na
2CrO
4溶液,实 现了 Na
2CrO
4到Na
2Cr
2O
7的转化,其原理如图2所示.

①钠离子交换膜的一种材料是聚丙烯酸钠
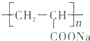
,聚丙烯酸钠单体的结构简式是
;
②写出阳极的电极反应式
(4)Na
2Cr
2O
7可用于测定废水的化学耗氧量(即C0D,指每升水样中还原性物质被氧化 所需要O
2的质量).现有某水样100.00mL,酸化后加入c
1mol/L的Na
2Cr
2O
7溶液 V
1mL,使水中的还原性物质完全被氧化(Cr
2O
还原为Cr
3+);再用4mol/L的FeSO
4溶液滴定剩 余的Cr
2O
,结果消耗FeSO
4溶液V
2mL.
①该水样的COD为
mg/L;
②假设上述反应后所得溶液中Fe
3+和Cr
3+的物质的量浓度均为0.1mol/L,要使Fe
3+沉 淀完全而Cr
3+还未开始沉淀.则需调节溶液pH的范围是
.
(可能用到的数据:K
sp[Fe(OH)
3]=4.0×10
-38,K
sp[Cr(OH)
3]=6.0×10
-31,lg
=-0.1,lg
=0.2,lg
=0.3,lg
=0.6)


 ①钠离子交换膜的一种材料是聚丙烯酸钠
①钠离子交换膜的一种材料是聚丙烯酸钠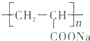 ,聚丙烯酸钠单体的结构简式是
,聚丙烯酸钠单体的结构简式是

 考前必练系列答案
考前必练系列答案 依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题: 利用如图所示装置测定中和热的实验步骤如下:
利用如图所示装置测定中和热的实验步骤如下: 用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:
用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答: