
£Ø1£©ŅŃÖŖ£ŗÖŲøõĖįøłĄė×Ó£ØCr2O72”Ŗ£©ŹĒ³ČŗģÉ«µÄ£¬øõĖįøłĄė×Ó£ØCrO42-£©ŹĒ»ĘÉ«µÄ£¬ÖŲøõĖį¼ŲČÜÓŚĖ®·¢Éś·“Ó¦£ŗCr2O72££«H2O  2CrO42££«2H£«£¬ČÜŅŗĪŖ³Č»ĘÉ«£¬ĻņČÜŅŗÖŠµĪ¼ÓÉŁĮ棶mol/LµÄĮņĖį£¬ČÜŅŗ³Ź________É«£¬ŌŅņŹĒ
2CrO42££«2H£«£¬ČÜŅŗĪŖ³Č»ĘÉ«£¬ĻņČÜŅŗÖŠµĪ¼ÓÉŁĮ棶mol/LµÄĮņĖį£¬ČÜŅŗ³Ź________É«£¬ŌŅņŹĒ
ӣ
 £Ø2£©ŅŃÖŖ£ŗ2NO2 N2O4 ¦¤H= -56.9kJ/mol”£Ņ»¶ØĢõ¼žĻĀ£¬½«øĆ»ģŗĻĢåĻµÖĆÓŚŅ»øö“ų»īČūµÄĢå»żæɱäµÄĆܱÕČŻĘ÷ÖŠ£¬ĶĘ¶Æ»īČūŅŌ¼õŠ”ČŻĘ÷µÄĢå»ż£¬“ĖŹ±µÄĻÖĻóŹĒ________________________________£¬ŌŅņŹĒ_________________________”£
£Ø2£©ŅŃÖŖ£ŗ2NO2 N2O4 ¦¤H= -56.9kJ/mol”£Ņ»¶ØĢõ¼žĻĀ£¬½«øĆ»ģŗĻĢåĻµÖĆÓŚŅ»øö“ų»īČūµÄĢå»żæɱäµÄĆܱÕČŻĘ÷ÖŠ£¬ĶĘ¶Æ»īČūŅŌ¼õŠ”ČŻĘ÷µÄĢå»ż£¬“ĖŹ±µÄĻÖĻóŹĒ________________________________£¬ŌŅņŹĒ_________________________”£
£Ø3£©½«NO2ŗĶN2O4»ģŗĻĘųĢåÖĆÓŚŗćČŻĆܱÕČŻĘ÷ÖŠ£¬½«øĆĢåĻµÉżĪĀÖĮ100oC£¬“ĖŹ±µÄĻÖĻóŹĒ_________________________£¬ŌŅņŹĒ__________________________”£

| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŹŅĪĀĻĀ£¬1Ģå»żĘųĢ¬ĢžŗĶŅ»¶ØĮæŃõĘų»ģŗĻ²¢³ä·ÖČ¼ÉÕŗó,ŌŁĄäČ“ÖĮŹŅĪĀ£¬ĘųĢåĢå»ż±Č·“Ó¦Ē°ĖõŠ”ĮĖ3Ģå»ż£¬ŌņĘųĢ¬ĢžŹĒ£Ø £©
A£®±ūĶé B£®ŅŅĻ© C£®¶”Ķé D£®¶”Č²
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀ±ķŹĒĻ”ĮņĖįÓėij½šŹō·“Ó¦µÄŹµŃ鏿¾Ż£ŗ
| ŹµŃéŠņŗÅ | ½šŹō ÖŹĮæ/g | ½šŹōדĢ¬ | c£ØH2SO4£© /mol”¤L-1 | V(H2SO4) /mL | ČÜŅŗĪĀ¶Č/”ę | ½šŹōĻūŹ§µÄŹ±¼ä/s | |
| ·“Ó¦Ē° | ·“Ó¦ŗó | ||||||
| 1 | 0.10 | Ėæ | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | ·ŪÄ© | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | Ėæ | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | Ėæ | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | ·ŪÄ© | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | Ėæ | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | Ėæ | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | Ėæ | 1.1 | 50 | 20 | 34 | 100 |
·ÖĪöÉĻŹöŹż¾Ż£¬»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ŹµŃé4ŗĶ5±ķĆ÷£¬ ¶Ō·“Ó¦ĖŁĀŹÓŠÓ°Ļģ£¬ÄܱķĆ÷Ķ¬Ņ»¹ęĀɵďµŃ黹ӊ £ØĢīŹµŃéŠņŗÅ£©£»
£Ø2£©±¾ŹµŃéÖŠÓ°Ļģ·“Ó¦ĖŁĀŹµÄ³żĮĖÅØ¶Č»¹ÓŠ £¬½ö±ķĆ÷øĆŅņĖŲ¶Ō·“Ó¦ĖŁĀŹ²śÉśÓ°ĻģµÄŹµŃéÓŠ £ØĢīŹµŃéŠņŗÅ£©”£
£Ø3£©ŹµŃéÖŠµÄĖłÓŠ·“Ó¦£¬·“Ó¦Ē°ŗóČÜŅŗµÄĪĀ¶Č±ä»ÆÖµ£ØŌ¼15”ę£©Ļą½ü£¬ĶĘ²āĘäŌŅņ£ŗ
ӣ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
°×Į×ŌŚŃõĘųÖŠČ¼Éյķ“Ó¦ĪŖ£ŗP4 + 5O2 = P4O10”£ŅŃÖŖ¶ĻĮŃĻĀĮŠ»Æѧ¼üŠčŅŖĪüŹÕµÄÄÜĮæ·Ö±šĪŖ£ŗP”ŖP a kJ”¤mol”Ŗ1”¢P”ŖO b kJ”¤mol”Ŗ1”¢P=O c kJ”¤mol”Ŗ1”¢O=O d kJ”¤mol”Ŗ1”£
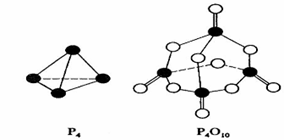
øł¾ŻĶ¼Ź¾µÄ·Ö×Ó½į¹¹ŗĶÓŠ¹ŲŹż¾ŻĻĀĮŠĶʶĻÕżČ·µÄŹĒ( )
A£®6a+5d < 4c + 10b B£®”÷H = (4c+12b£6a£5d) kJ”¤mol”Ŗ1
C£®6a+5d > 4c + 12b D£®”÷H = (6a+5d£4c£12b) kJ”¤mol”Ŗ1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
 ĻĀĮŠĄė×Ó·½³ĢŹ½ÕżČ·µÄŹĒ£Ø £©
ĻĀĮŠĄė×Ó·½³ĢŹ½ÕżČ·µÄŹĒ£Ø £©
 A£®³ĪĒåŹÆ»ŅĖ®ÓėŃĪĖį·“Ó¦£ŗH+ + OH- £½ H2O
A£®³ĪĒåŹÆ»ŅĖ®ÓėŃĪĖį·“Ó¦£ŗH+ + OH- £½ H2O
 B£®°Ń½šŹōĢś·ÅČėĻ”H2SO4ÖŠ·“Ó¦£ŗ2Fe + 6H+ £½ 2Fe3+ + 3H2 ”ü
B£®°Ń½šŹōĢś·ÅČėĻ”H2SO4ÖŠ·“Ó¦£ŗ2Fe + 6H+ £½ 2Fe3+ + 3H2 ”ü
 C£®
C£®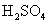 Óė
Óė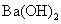 ČÜŅŗ·“Ó¦£ŗBa2+ + H+ + OH£+ SO42”Ŗ£½ BaSO4 ”ż+ H2O
ČÜŅŗ·“Ó¦£ŗBa2+ + H+ + OH£+ SO42”Ŗ£½ BaSO4 ”ż+ H2O
 D£®
D£®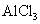 ČÜŅŗÖŠ¼ÓČė¹żĮæµÄÅØ°±Ė®£ŗAl3+ + 4NH3”¤H2O = AlO2£+ 4NH4+ + 2H2O
ČÜŅŗÖŠ¼ÓČė¹żĮæµÄÅØ°±Ė®£ŗAl3+ + 4NH3”¤H2O = AlO2£+ 4NH4+ + 2H2O
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŌŚŅ»¶ØĪĀ¶ČĻĀ£¬10LĆܱÕČŻĘ÷ÖŠ¼ÓČė5molSO2”¢4.5molO2£¬¾10minŗó·“Ó¦“ļĘ½ŗāŹ±ÓŠ3molSO2·¢ÉśĮĖ·“Ó¦”£
£Ø1£©O2µÄ×Ŗ»ÆĀŹĪŖ¶ąÉŁ£æ (¼ĘĖć½į¹ū±£ĮōŠ”ŹżµćŗóŅ»Ī»Źż×Ö)
£Ø2£©Ę½ŗāŹ±ČŻĘ÷ÄŚĘųĢåŃ¹ĒæÓė·“Ó¦Ē°µÄŃ¹ĒæÖ®±ČĪŖ¶ąÉŁ?(×ī¼ņÕūŹż±Č)
£Ø3£©Ę½ŗāŹ±ĢåĻµÖŠSO3µÄ°Ł·Öŗ¬Įæ£ØĢå»ż·ÖŹż£©ĪŖ¶ąÉŁ£æ(¼ĘĖć½į¹ū±£ĮōŠ”ŹżµćŗóŅ»Ī»Źż×Ö)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
¼×“¼ÖŹ×Ó½»»»Ä¤Č¼ĮĻµē³ŲÖŠ½«¼×“¼ÕōĘų×Ŗ»ÆĪŖĒāĘųµÄĮ½ÖÖ·“Ó¦ŌĄķŹĒ
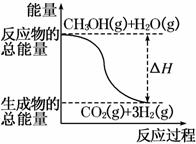 ¢ŁCH3OH(g)£«H2O(g)===CO2(g)£«3H2(g) ¦¤H£½£«49.0 kJ/mol
¢ŁCH3OH(g)£«H2O(g)===CO2(g)£«3H2(g) ¦¤H£½£«49.0 kJ/mol
¢ŚCH3OH(g)£«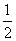 O2(g)===CO2(g)£«2H2(g)””¦¤H£½£192.9 kJ/mol
O2(g)===CO2(g)£«2H2(g)””¦¤H£½£192.9 kJ/mol
ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ (””””)
A£®CH3OHµÄČ¼ÉÕČČĪŖ192.9 kJ/mol
B£®·“Ó¦¢ŁÖŠµÄÄÜĮæ±ä»ÆČēĻĀĶ¼ĖłŹ¾
C£®CH3OH×Ŗ±ä³ÉH2µÄ¹ż³ĢŅ»¶ØŅŖĪüŹÕÄÜĮæ
D£®øł¾Ż¢ŚĶĘÖŖ·“Ó¦CH3OH(l)£«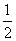 O2(g)===CO2(g)£«2H2(g)µÄ¦¤H£¾£192.9 kJ/mol
O2(g)===CO2(g)£«2H2(g)µÄ¦¤H£¾£192.9 kJ/mol
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
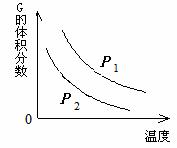
ŌŚŅ»ĆܱÕČŻĘ÷ÖŠÓŠČēĻĀ·“Ó¦£ŗ L (s) + a G (g)  b R (g) ĪĀ¶ČŗĶŃ¹Ēæ¶ŌøĆ·“Ó¦µÄÓ°ĻģČēÓŅĶ¼ĖłŹ¾£¬ĘäÖŠŃ¹ĒæP1 < P2£¬
b R (g) ĪĀ¶ČŗĶŃ¹Ēæ¶ŌøĆ·“Ó¦µÄÓ°ĻģČēÓŅĶ¼ĖłŹ¾£¬ĘäÖŠŃ¹ĒæP1 < P2£¬
ÓÉ“ĖæÉÅŠ¶Ļ£Ø £©
A£®Õż·“Ó¦ĪŖ·ÅČČ·“Ó¦
B£®»Æѧ·½³ĢŹ½ÖŠµÄ¼ĘĮæŹża £¾ b
C£®GµÄ×Ŗ»ÆĀŹĖęĪĀ¶ČÉżø߶ų¼õŠ”
D£®Ōö“óŃ¹Ēæ£¬ČŻĘ÷ÄŚĘųĢåÖŹĮæ²»±ä
 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠ·ÖĄą²»ÕżČ·µÄŹĒ £Ø £©
A£®“æ¼ī”¢ÉÕ¼ī¾łŹō¼īĄą B£®CO2”¢SO2¾łŹōĖįŠŌŃõ»ÆĪļ
C£®“×Ėį”¢ĮņĖį”¢ĻõĖį¾łŹōĖįĄą
D£®Na2CO3”¢Na2SO3”¢NaCl¶¼ŹōÄĘŃĪ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com